
【题目】2019年为“国际化学元素周期表年”。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是( )
![]()
A.原子半径:W<X
B.X的最高价氧化物的水化物是强碱
C.Y单质可用做半导体材料
D.气态氢化物热稳定性:Z<W
科目:高中化学 来源: 题型:
【题目】某同学设计了如下实验流程:在一个小烧杯里,加入20gBa(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图如图所示,回答下列问题:

(1)实验中玻璃棒的作用是___________________。
(2)浸有稀硫酸的棉花的作用是___________________。
(3)请写出该反应的化学反应方程式:______________________________。
(4)通过______________________________现象,说明该反应为___________________(填“吸热”或“放热”)反应,这是因为反应物的总能量___________________(填“>”“<”或“=”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32—+3H2O。
(1)负极上的电极反应为____________________________________。
(2)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,依次进行如下实验:
①取一定量冰醋酸,配制成100mL0.1mol/L醋酸溶液;
②取20mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
③继续滴加amL0.1mol/L稀盐酸,至溶液的pH=7。
下列说法正确的是
A.①中溶液的pH=1
B.②中反应后溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.③中,a=20
D.③中,反应后溶液:c(Na+)=c(CH3COO-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应能量的说法正确的是( )
A.若反应A=B △H<0,说明A物质比B物质稳定,分子内共价键键能 A比B大
B.Zn(s)+CuSO4 (aq)==ZnSO4 (aq) +Cu(s) △H= -216 kJ·mol-1。则反应物总能量>生成物总能量
C.101kPa时,2H2(g)+O2(g)==2H2O(g) △H= -Q kJ·mol-1,则H2的燃烧热为1/2Q kJ·mol-l
D.H+(aq) +OH- (aq)=H2O(l) △H= -57.3 kJ·mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol CH3COOH的醋酸溶液混合后会放出57.3 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学热力学是物理化学的重要分支。请根据所学知识回答下列问题:
(1)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
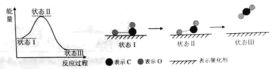
①CO和O生成CO2是______反应(填吸热或放热)
②状态Ⅲ生成的分子含有____(填极性键或非极性键),该分子的电子式____
(2)已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。(填=、>或<)
2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。(填=、>或<)
(3)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。(填=、>或<)
(4)用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,

反应①为2HCl(g) + CuO(s) =H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2
则总反应的热化学方程式为_______, (反应热用△H1和△H2表示)。
(5)已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的ΔH=________
(6)乙苯催化脱氢制苯乙烯反应:![]() (g)
(g)![]()
![]() (g)+H2(g)
(g)+H2(g)
已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是( )
A.Zn2+基态核外电子排布式为[Ar]3d10
B.1molHCHO分子中含有σ键的数目为3mol
C.HOCH2CN分子中碳原子轨道的杂化类型是sp3
D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为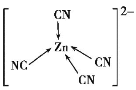
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子M只含有C、H、O三种元素,其球棍模型如图所示。下列有关M的说法正确的是( )
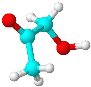
A.M中只含有一种官能团
B.M与浓硫酸共热能发生消去反应
C.M能与H2在一定条件下发生加成反应
D.M和乙酸互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com