
���ʹ�������ǿ����������ܵ���Ҫ�о�����
��1��Ti��BH4��3��һ�ִ�����ϣ�����TiCl4��LiBH4��Ӧ�Ƶã�
�ٻ�̬Clԭ���У�����ռ�ݵ�����ܲ����Ϊ �����ܲ���е�ԭ�ӹ����Ϊ ��
��LiBH4��Li+��BH4�����ɣ�BH4��������ṹ�� ��Bԭ�ӵ��ӻ���������� ��
Li��B��HԪ�صĵ縺���ɴ�С����˳��Ϊ ��
��2�������⻯���Ǿ������÷�չǰ���Ĵ�����ϣ�
��LiH�У����Ӱ뾶Li+ H�������������=������������ij��������ǵ������ڽ���Ԫ��M���⻯�M�IJ��ֵ����������ʾ��
I1/kJ•mol��1 | I2/kJ•mol��1 | I3/kJ•mol��1 | I4/kJ•mol��1 | I5/kJ•mol��1 |
738 | 1451 | 7733 | 10540 | 13630 |
M�� ����Ԫ�ط��ţ���
��3��NaH����NaCl�;���ṹ����֪NaH����ľ�������a=488pm���ⳤ����Na+�뾶Ϊ102pm��H���İ뾶Ϊ ��NaH�������ܶ��� g•cm��3��ֻ����ʽ�����ؼ������ֵ�������ӵ�����ΪNA��
 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ��ͨ�и����߿�ȫ��ģ�⣨һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�л���A�Ľṹ��ʽ��ͼ��ʾ�������й���������ȷ����
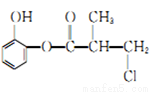
A. �л���A��Ũ�����ϼ���,���Է�����ȥ��Ӧ
B. 1 molA ��������H2�����ӳɷ�Ӧ,����������4mol H2
C. 1 molA ��������NaOH ��Һ��ַ�Ӧ,����������4 mol NaOH
D. �л���A ��ͬ���칹��������ϡ���������ˮ�����ɶ����ӵ���6 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и�һ��ѧ�ڵ�һ���¿���3�£���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���в���ȷ���ǣ� ��
����������ͬ����һ������ͬ��Ԫ��
��ͬλ�ص����ʼ�����ȫ��ͬ
����������ͬ��������Ҳ��ͬ��������������һ�ַ��Ӻ�һ������
�ܵ�������ͬ������һ����ͬһ��Ԫ��
��һ��Ԫ��ֻ����һ��������
��ij��Ԫ�ص����ԭ������ȡ����������������
A. �٢ڢܢ� B. �ۢܢݢ� C. �ڢۢݢ� D. �٢ڢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ĵ�ʡ�ɶ��б���У��2016-2017ѧ���һ3���¿���ѧ�Ծ� ���ͣ�ѡ����
��A��B���ֶ�����Ԫ�أ�ԭ�Ӱ뾶��:r(A)<r(B)����A��B����Ԫ��ԭ�ӵ�������������ͬ(ѡ���е�m��n��Ϊ������)������˵����ȷ����( )
A. ��B(OH)m��ǿ���A(OH)mһ��Ϊǿ��
B. ��HnAOm��ǿ�ᣬ��B������������Ӧ��ˮ����һ��Ϊǿ��
C. ��B�ǽ�������A�����Ƿǽ�������B�Ƿǽ�������A�����ǽ���
D. �����£���BԪ�ص��⻯�������壬��AԪ�ص��⻯�������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ĵ�ʡ�ɶ��б���У��2016-2017ѧ���һ3���¿���ѧ�Ծ� ���ͣ�ѡ����
���й������ӻ�������ۻ������˵����ȷ����( )
�����ӻ�����һ�������Ӽ���Ҳ���ܺ����Լ��ͷǼ��Լ���
�ڹ��ۻ�����һ�������ۼ���Ҳ���ܺ����Ӽ���
�ۺ�����Ԫ�صĻ����ﲻһ�������ӻ����
���ɷǽ���Ԫ�ع��ɵĻ�����һ���ǹ��ۻ����
�����ַǽ���Ԫ���ܹ��γ����ӻ����
������״̬�ܵ���Ļ�����һ�������ӻ�����
A. �٢ۢݢ� B. �٢ۢ� C. �٢ݢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ȫ���¿γ̸߿�������Ϣ���ۣ�һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���ijŨ�ȵ���ˮ�е���Na2S03��Һ��pH�仯��ͼ��ʾ����������Ũ�ȵĹ�ϵ�������
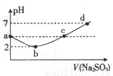
A. a�㣺c(H+)>c(Cl-)>c(ClO-)
B. b�㣺l/2 c(Cl-)��c(SO42-)=0.005mol��L-1
C. �㣺c(Na+)=2c(HSO3-)+2c(SO32-)
D. d �㣺c(Na+)��c(Cl-)+c(HSO3-)+2c(SO32-)+2c(SO42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ�Э����2017�������19�죨3�£��������ۻ�ѧ�Ծ� ���ͣ������
�����仯������������������;�㷺���ش��������⣺
��1����һ�������£�����Al��Cu�����γɽ���������Cu9Al4����̬Alԭ�Ӻ��������_____�ֲ�ͬ���˶�״̬����̬Cuԭ�ӵĺ�������Ų�ʽΪ______________��
��2��Na��Mg��Al����Ԫ���У���һ������������_______��ԭ����_____________��
��3��Al3+��Cl-���γ���λ����[AlCl4]-������Al��Cl֮���γɵĻ�ѧ������Ϊ______������Ӽ��������Լ����Ǽ��Լ�������Alԭ�ӵ���λ��Ϊ______��Alԭ�ӵ��ӻ���ʽΪ_______��[AlCl4]-�Ŀռ乹��Ϊ_____����д��һ��[AlCl4]-��Ϊ�ȵ�����������ţ�____________��
��4��AlN�ľ���ṹ����ʯ���ƣ������ṹ��ͼ��ʾ�������к���_____����ԭ�ӣ���Al��Nԭ���������Ϊapm����þ�����ܶ�Ϊ______g/cm3���������ӵ�������NA��ʾ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��߿���Ϣ����ȫ����I�������ۺϣ�һ����ѧ�Ծ��������棩 ���ͣ�ѡ����
���й�ϵ�ı����У���ȷ����( )
A. 0.1mol��L-1��Na2CO3��Һ�У�c(Na+)+c(H+)=2c(CO32-)+c(OH-)
B. 0.1mol��L-1��NH4Cl��Һ�У�c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. ǡ����ȫ�к�pH���������ͬ������ʹ��ᣬ����Na0H�����ʵ�����ͬ
D. pH=4�������pH=4��FeC13��Һ�У�ˮ�����c(H+)�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ��ͨ�и����߿�ȫ��ģ�⣨������ѧ�Ծ��������棩 ���ͣ�ѡ����
�ϳɿɽ���ۺ���G��ij���̵����һ������ͼ�������й�˵������ȷ����
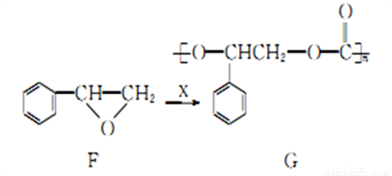
A. ��֪�ò�ת�������е�ԭ��������Ϊ100%����XΪCO2
B. �л���F���ڷ����廯����������ڷ�����
C. (C9H8O3)n���Ǹ߷���G�Ļ�ѧʽҲ�������ڵĻ�ѧʽ
D. ��֪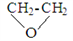 ��ˮ�������Ҷ�������F��G��һ��������ˮ�⣬�ɵ���ͬ�IJ���
��ˮ�������Ҷ�������F��G��һ��������ˮ�⣬�ɵ���ͬ�IJ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com