
在pH=1的无色为溶液中,能大量共存的离子组是( )
A.NH4+、Mg2+、SO42-、Cl-
B.Ba2+、K+、OH-、Cl-
C.Al3+、MnO4-、SO42-、Cl-
D.Na+、Cu2+、Cl-、Ba2+
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源:2013-2014学年山东省烟台市高三上学期期末统考化学试卷(解析版) 题型:填空题
由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示(某产物已略去):

已知:B、X为单质,常温下D为无色液体,A、B含同一种元素。
请回答下列问题:
(1)若E气体是大气污染物,F是一元强酸。
①写出E→F反应的化学方程式: 。
②现有25℃时0.1 mol·L-1 A的水溶液,若向其中加入等体积0.1 mol·L-1的稀硫酸,则所得溶液中各离子的物质的量浓度由大到小的顺序是 。
③在常温下,向V1 L pH=a的A的水溶液中加入V2 L pH=b的盐酸,且a+b=14,若恰好完全反应,则V1和V2的关系为Vl V2(填“>”、“<”、“=”或“无法确定”),等pH的所得溶液与盐酸比较,由水电离出的c(H+)前者为后者的108倍,则两种溶液的pH= 。
(2)若E气体不是大气污染物,F是二元弱酸。
①B所含元素在周期表中的位置 。
②写出氧化铁与C反应的化学方程式: ;将少量气体E通入氢氧化钙溶液中得不溶物F,F的Ksp=2.8×10-9。现将该沉淀放入0.1 mol·L-1的CaCl2溶液中,其Ksp (填“增大”、“减小”或“不变”),此时,组成不溶物F的阴离子在溶液中的浓度为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三考前模拟化学试卷(解析版) 题型:计算题
铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
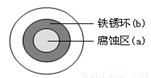
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是 区(填“正极”或“负极”),其电极反应式为 。
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O= TiO2+(无色)+Fe2++2H+
③ 。
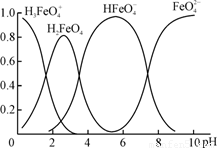
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是 。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁 g。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三下学期第一次统练化学试卷 题型:填空题
(16分).铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体。由图 1 知金属铬的活动性比铜_____(填强,弱),图 2装置中铬电极的电极反应式

(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸, CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为_____________________________________________________________。
(3)存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①若平衡体系的pH=2,则溶液显 色.
②能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) =v (CrO42—) c.溶液的颜色不变
(4)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L1,则溶液中c(Cr3+)为____ mol·L-1。
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。

从开始加热到 750K 时总反应方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三第六次模拟考试(理综)化学部分 题型:填空题
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。

(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)根据信息完成下列方程式。
(1) 化工厂为了检验输送氯气的管道是否漏气,用蘸有浓氨水的粗玻璃棒接近管道,根据是否有白烟产生来判断。用方程式表示其原理。
。
(2) FeSO4溶液在pH=2的硫酸溶液中,暴露在空气中是比较稳定的。如在该溶液中加入氧化亚铁硫杆菌后,大部分Fe2+离子可迅速转化成Fe3+(Fe3+是浸出硫化矿物的良好的出剂)。这一反应是细菌浸出矿物的重要反应之一,该反应方程式为:
。
(3) 四氢硼酸钠(NaBH4)是一种重要的广谱还原剂,写出它在碱性溶液中将Ru3+离子还原为金属的反应的离子方程式。
。
(4) 向KI和H2SO4的混合溶液中加入过氧化氢,放出大量不溶于水的无色气体,同时溶液呈棕黄色,可使淀粉变蓝。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com