
【题目】一定量铜与100mLcmol/L的稀硝酸反应,产生1.12LNO(标准状况),反应结束后,向反应后的溶液中滴加1.0mol/L的NaOH溶液,滴加过程中,产生沉淀的质量与加入NaOH 溶液的体积关系如下图所示。

回答下列问题:
(1)写出铜与稀硝酸反应的离子方程式_____________________________________________。
(2)铜与稀硝酸反应中被还原HNO3的物质的量为________mol。
(3)铜与稀硝酸反应后的溶液中,H+的物质的量浓度为________mol/L(反应前后溶液体积变化忽略不计)。
(4)稀硝酸的物质的量浓度c=______mol/L。
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液使其全部转化为NaNO3,反应的化学方程式是______________________________________。
【答案】3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 0.05 0.5 2.5 2NO+2NaOH+3H2O2=2NaNO3+4H2O
【解析】
(1)铜和稀硝酸反应生成硝酸铜、NO和水;
(2)铜与稀硝酸反应中被还原HNO3反应后生成NO,由氮原子守恒来计算;
(3)反应结束后,向反应后的溶液中滴加1.0mol·L-1的NaOH溶液时,NaOH先和H+反应,将H+反应完后,再去和Cu2+反应,由图示,剩余的H+反应消耗50mLNaOH溶液;
(4)当加入氢氧化钠溶液200mL时,溶液中的H+、Cu2+反应完全,溶液中的溶质为NaNO3,据此求出溶液中n(NO3-),然后根据稀硝酸中n(HNO3)=n(NO3-)+n(NO)求出硝酸的物质的量,稀硝酸的浓度;
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液,则NO做还原剂被氧化为NaNO3,双氧水被还原。
(1)铜和稀硝酸反应生成硝酸铜、NO和水,故离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)铜与稀硝酸反应中被还原的HNO3反应后生成NO,而反应生成的NO的物质的量为0.05mol,根据1mol硝酸被还原则生成1molNO可知,被还原的硝酸为0.05mol;
(3)反应结束后,向反应后的溶液中滴加1.0mol·L-1的NaOH溶液时,NaOH先和H+反应,将H+反应完后,再去和Cu2+反应,根据图示可知,剩余的H+反应消耗50mLNaOH溶液,根据1molH+~1molNaOH可知,反应后的溶液中氢离子的物质的量n(H+)=n(NaOH)=cV=1mol·L-1×0.05L=0.05mol,则c(H+)=n(H+)/V=0.05mol÷0.1L=0.5mol·L-1;
(4)当加入氢氧化钠溶液200mL时,溶液中的H+、Cu2+反应完全,溶液中的溶质只有NaNO3,故溶液中的n(NO3-)=n(Na+)=n(NaOH)=1mol·L-1×0.2L=0.2mol,而原稀硝酸中n(HNO3)=n(NO3-)+n(NO)=0.2mol+0.05mol=0.25mol,故稀硝酸的浓度c=0.25mol÷0.1L=2.5mol·L-1;
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液,则NO做还原剂被氧化为NaNO3,双氧水被还原为H2O,故化学方程式为2NO+2NaOH+3H2O2=2NaNO3+4H2O。


科目:高中化学 来源: 题型:
【题目】某含氧有机化合物可以作为无铅汽油的抗爆震剂,其相对分子质量为88.0,含C的质量分数为0.682,含H的质量分数为0.136,其余为O。
(1)试确定该化合物的分子式______。(写出计算过程)
(2)经红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是______________。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:_________
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是________________________________。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是______________________。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在当下热播的电视剧《人民的名义》中,达康书记正在参加省委召开的“开展垃圾分类,建设美丽厦门”扩大会议。达康书记问环保局长: 下列哪一组垃圾都是可回收垃圾
A. 果皮、旧报纸、废电池 B. 剩饭、鱼骨头、玻璃瓶
C. 饮料瓶、玻璃酒瓶、废作业本 D. 易拉罐、旧衣物、手机电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.Ca2+、HCO3-、K+、NO3-B.HCO3-、H+、Ba2+、Na+
C.HCO3-、OH-、Al3+、Na+D.Mg2+、Fe3+、OH-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某草酸晶体(H2C2O42H2O)样品的纯度,现称取一定质量的该样品,配制成100 mL溶液,取25.00 mL该溶液于锥形瓶中,加适量稀硫酸,用0.100 mol/L的KMnO4溶液滴定(杂质不参与反应)。为省去计算过程,当称取的样品的质量为某数值时,滴定所用KMnO4溶液的毫升数恰好等于样品中草酸晶体的质量分数的100倍。则应称取样品的质量为
A. 2.25 g B. 3.15 g C. 9.00 g D. 12.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物,下列说法错误的是

A. 步骤(3)需要用到坩埚B. 步骤(2)需要用到分液漏斗
C. 步骤(1)需要过滤装置D. 步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
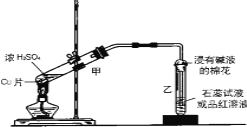
(1)写出甲装置中发生的主要反应的化学方程式____________________________。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是_________________________。
(3)生成的气体使品红溶液的颜色______________;实验完毕后,取少量乙试管中溶液于试管中加热,现象是________________;原因是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com