
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol![]() L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
(3)滴定过程中,眼睛应注视_________________,若用酚酞作指示剂达到滴定终点颜色变化是____________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是_____molL-1,烧碱样品的纯度是____(保留小数点后两位)
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
① 观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果____。
② 若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果______________。
【答案】 2NaOH(aq)+H2SO4(aq)=2H2O(l) +Na2SO4 (aq) △H= -114.6kJ·mol—1 烧杯、玻璃棒、500 mL容量瓶、胶头滴管 锥形瓶内溶液颜色变化 溶液由浅红色变成无色,且半分钟内不恢复原色 0.400 97.56% 偏高 偏高
【解析】(1)氢氧化钠与硫酸反应的中和热ΔH=-57.3 kJ/mol,则反应的热化学方程式为:2NaOH(aq)+H2SO4(aq)=2H2O(l) +Na2SO4 (aq) △H= -114.6kJ·mol—1;配成500mL待测溶液需要的玻璃仪器有烧杯、玻璃棒、500 mL容量瓶、胶头滴管等;(3)滴定过程中,眼睛应注视锥形瓶内溶液颜色变化,若用酚酞作指示剂达到滴定终点颜色变化是溶液由浅红色变成无色,且半分钟内不恢复原色;(4)V(标准)=![]() =20.00mL,c(待测)═2×
=20.00mL,c(待测)═2×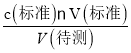 =2×
=2×![]() ═0.4000molL-1, m(烧碱)═
═0.4000molL-1, m(烧碱)═![]() ═0.4000molL-1×0.5L×40g/mol═8.0g,ω═
═0.4000molL-1×0.5L×40g/mol═8.0g,ω═![]() ×100%═97.56%;(5)①开始俯视,滴定终点平视,导致计算出的标准液体积偏大,浓度偏高;②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,导致待测液的物质的量增加,消耗的标准液体积增大,结果偏高。
×100%═97.56%;(5)①开始俯视,滴定终点平视,导致计算出的标准液体积偏大,浓度偏高;②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,导致待测液的物质的量增加,消耗的标准液体积增大,结果偏高。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)NaF 的水溶液呈__(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____,溶液中含有的各离子浓度从大到小的顺序为______。
(2)AlCl3 水溶液呈__(填“酸”、“中”、“碱”)性,把 AlCl3 溶液蒸干,灼烧,最后得到的主要固体产物是 ______。
(3)CaCl2 溶液与 Na2CO3 溶液混合可形成 CaCO3 沉淀,现将 4×10-4mol/L Na2CO3 溶液与某浓度的 CaCl2溶液等体积混合,则生成沉淀所需 CaCl2 溶液的最小浓度为__ mol·L-1(已知:KSP(CaCO3)=2.8×10-9)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() H、
H、 ![]() H、
H、 ![]() H三种核素的性质不同
H三种核素的性质不同
B.16O2、18O2彼此是同位素
C.14N、14C两种核素的中子数相同,质子数不同
D.白磷与红磷是磷元素的两种同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,请参照元 素①﹣⑩在表中的位置回答下列问题. 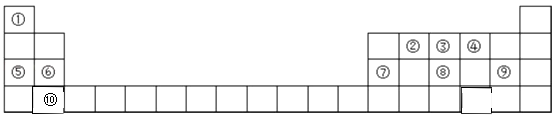
(1)在这 10 种元素中,原子半径最大的是(填元素符号).
(2)⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是 . (填化学式)
(3)写出⑨形成的单质和水反应的离子方程式 .
(4)写出①、④元素组成的化合物的电子式是、 .
(5)④⑤⑥⑦对应的离子半径最小的是(填离子符号).
(6)写出实验室制取③的气态氢化物的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验. 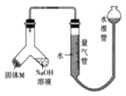
(1)如何检验该装置的气密性?
(2)合金样品固体 M 与氢氧化钠溶液反应的离子方程式是 .
(3)倾斜左边装置使氢氧化钠溶液(足量)与质量为 a 的合金粉末(固体 M)充分反应,待反应停止后,进入量气管气体的体积为 V mL(已折算成标准状况).若量气管最大量 为 50mL,则固体 M 中铝的质量[m(Al)]范围为 .
(4)为了准确地测量氢气的体积,在读取量气管中液面读数的过程中,应注意:①读数时 视线与凹液面最低处相平,②
(5)若 a=38mg,V=44.8mL(标准状况),通过计算可知,该合金中铝的质量分数为(精确到小数点后 1 位).
(6)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积(填“>”“<”或“=”)V.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,密闭容器中充入一定量的NO2和SO2 , 发生如下反应:NO2+SO2 ![]() NO+SO3 , 平衡时,下列叙述正确的是( ) ①NO和SO3 的物质的量一定相等
NO+SO3 , 平衡时,下列叙述正确的是( ) ①NO和SO3 的物质的量一定相等
②NO2和SO2的物质的量一定相等
③体系中的总物质的量一定等于反应开始时总物质的量
④SO2、NO2、NO、SO3 的物质的量一定相等.
A.①和②
B.②和③
C.①和③
D.③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下四种物质(标准状况下):①11.2L二氧化碳,②19.2g甲烷,③9.03×1023个氮气分子,④1mol的H2S气体.标准状况下体积最小的是(填序号,下同),它们所含分子数最多的是 , 所含原子数最多的是 , 质量最小的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com