
【题目】向BaCl2溶液中通入SO2将溶液分置于两支试管中,向一份中加入NaOH溶液,出现白色沉淀A,另一份通入少量Cl2 , 产生白色沉淀B,试回答下列问题:
(1)若不考虑SO2与水的反应向BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”.此处应为 , 原因是 .
(2)沉淀A的化学式为 , 该沉淀能否溶于稀盐酸? .
(3)写出生成沉淀B的离子方程式: .
(4)生成2.33 g沉淀B,需消耗标准状况下的Cl2mL.
【答案】
(1)不反应;H2SO3酸性小于盐酸
(2)BaSO3;能
(3)2H2O+SO2+Cl2+Ba2+=BaSO4↓+2Cl﹣+4H+
(4)224
【解析】解:(1)H2SO3酸性小于盐酸,亚硫酸和BaCl2混合不符合复分解反应的条件,所以SO2和BaCl2溶液不反应,故答案为:不反应;H2SO3酸性小于盐酸;(2)SO2和NaOH溶液反应生成亚硫酸钠,亚硫酸钠和BaCl2发生复分解反应生成BaSO3 , 所以A为BaSO3 , BaSO3能溶于稀盐酸,故答案为:BaSO3;(3)氯气具有强氧化性,二氧化硫具有还原性,二者在水溶液里发生氧化还原反应生成硫酸和盐酸,硫酸和氯化钡发生复分解反应,离子方程式为2H2O+SO2+Cl2+Ba2+=BaSO4↓+2Cl﹣+4H+ , 故答案为:2H2O+SO2+Cl2+Ba2+=BaSO4↓+2Cl﹣+4H+;(4)B是硫酸钡,n(BaSO4)= ![]() =0.01mol,根据S原子守恒知n(BaSO4)=n(SO2)=0.01mol, 根据转移电子守恒知参加反应的n(SO2)=n(Cl2)=0.01mol,则V(Cl2)=0.01mol×22.4L/mol=0.224L=224mL,
=0.01mol,根据S原子守恒知n(BaSO4)=n(SO2)=0.01mol, 根据转移电子守恒知参加反应的n(SO2)=n(Cl2)=0.01mol,则V(Cl2)=0.01mol×22.4L/mol=0.224L=224mL,
故答案为:224.
(1)H2SO3酸性小于盐酸,所以SO2和BaCl2溶液不反应;(2)SO2和NaOH溶液反应生成Na2SO3 , Na2SO3和BaCl2发生复分解反应;亚硫酸盐沉淀能溶于稀盐酸;(3)氯气具有强氧化性,SO2具有还原性,二者在水溶液里发生氧化还原反应生成H2SO4和盐酸,硫酸和氯化钡发生复分解反应;(4)B是硫酸钡,根据S原子守恒计算SO2的物质的量,再结合转移电子守恒计算氯气的体积.


科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( ) 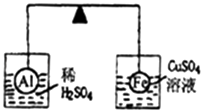
A.铝球一定是空心的
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯杠杆仍平衡
D.右边铁球上出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验事实得出的结论正确的是( )
A.由SiO2不能与水反应生成H2SiO3 , 可知SiO2不是H2SiO3的酸酐
B.由SiO2+2C ![]() Si+2CO↑,可知碳的非金属性大于硅
Si+2CO↑,可知碳的非金属性大于硅
C.CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3
D.SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列三种气态物质之间的反应:
C2H2(g)+H2(g)![]() C2H4(g)①
C2H4(g)①
2CH4(g)![]() C2H4(g)+2H2(g)②
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g)=CH4(g) ΔH=-Q1kJ/mol
C(s)+![]() H2(g)=
H2(g)=![]() C2H2(g) ΔH=-Q2kJ/mol
C2H2(g) ΔH=-Q2kJ/mol
C(s)+H2(g)=![]() C2H4(g) ΔH=-Q3kJ/mol
C2H4(g) ΔH=-Q3kJ/mol
Q1、Q2、Q3均为正值,下列关系正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学追求减少化工生产对环境造成的污染,下列物质可以称为“绿色氧化剂”的是( )
A.H2O2B.KMnO4C.HNO3D.Ca(ClO)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是( )
A.所含分子数目相同
B.所含氢原子物质的量之比为3:4
C.质量之比为16:17
D.密度之比为17:16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D. 25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com