
| 解析:方法一:据题意三种元素在周期表中的位置可能有四种排列方式:
设X的质子数为a,则(1)至(4)式有下列关系: (1)a+(a+8)+(a+9)=38 解得a=7(合理) (2)a+(a+8)+(a+7)=38 解得a为非整数(不合理) (3)a+(a-8)+(a-7)=38 解得a为非整数(不合理) (4)a+(a-8)+(a-9)=38 解得a为非整数(不合理) 故推知X、Y、Z分别是N、O、S. 方法二:X、Y、Z为周期表中相邻的三种元素,最外层电子数平均为5.3个,根据三者最外层电子数为16(偶数)可知,X、Y最外层电子数必为5,这两者(N和P)质子数之和为22,故Z的质子数为38-22=16,故Z为S,同时也可进一步确定X为N,Y为P.
|


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源:物理教研室 题型:013
A.Y的原子半径大于Z的原子半径 B.X可能为金属元素
C.Y与Z不可能形成离子型的化合物 D.Z一定为非金属元素
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)三种元素符号:
X________________、Y________________、Z________________.
(2)Z2Y2的电子式为________________.
(3)XY2跟Z2Y2发生氧化还原反应生成一种盐,该反应式为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列为元素周期表的一部分,表中阿拉伯数字(1、2……)是原周期表中行或列的序号。请参照元素A~I在表中的位置,回答下列问题。
|
(1)B、C两元素中非金属性较强的是 (写出元素名称),请设计一个简单的实验证明这一结论 。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M。写出Z与Y反应的化学方程式: 。
(4)I元素在周期表里的位置在第 周期、第 族。
实验室中采用右图所示装置模拟工业上同时制取元素A和I
的单质过程: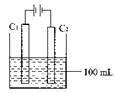
①写出电极C1上发生反应的电极反应式 。
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH= 。(![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com