
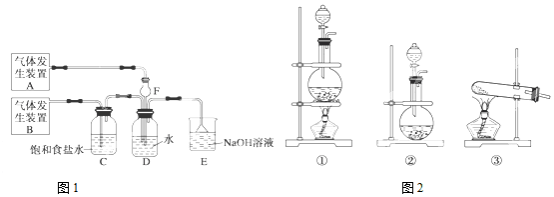
分析 (1)启普发生器适用于固液混合状态其不需加热而制取的气体,且固体必须是块状的;根据药品状态和反应条件选择;
(2)气体容易与水反应,且溶解度较大会发生倒吸;装置E的作用是吸收尾气;
(3)D中是二氧化硫和氯气发生的氧化还原反应生成硫酸和盐酸,依据反应产物写出方程式;
(4)①氯气过量,D溶液使紫色石蕊试液先显红色再褪色;
②二氧化硫过量,D溶液有还原性,使酸性高锰酸钾褪色.
解答 解:(1)启普发生器适用于固液混合状态其不需加热而制取的气体,且固体必须是块状的,而Na2SO3固体为粉末状,不能使用启普发生器制取二氧化硫,气体发生装置B为制取氯气,由二氧化锰和浓盐酸加热制备,选用装置①;
故答案为:不能;启普发生器适用于固液混合状态其不需加热而制取的气体,且固体必须是块状的,而Na2SO3固体为粉末状;①;
(2)SO2易与水反应,且溶解度较大会发生倒吸,则F可以防倒吸,二氧化硫和氯气不能直接排放至空气中,用氢氧化钠吸收;
故答案为:防倒吸;吸收尾气;
(3)D中是二氧化硫和氯气发生的氧化还原反应生成硫酸和盐酸,反应的方程式为:Cl2+SO2+2H2O═H2SO4+2HCl;
故答案为:Cl2+SO2+2H2O═H2SO4+2HCl;
(4)为验证通入D装置中气体是Cl2还是SO2过量,
①若Cl2过量:取适量D中溶液滴加至盛有紫色石蕊溶液,溶液先变红色,后无色;
故答案为:紫色石蕊溶液;溶液先变红色,后无色;
②若SO2过量:取适量D中溶液滴加至盛有酸性高锰酸钾溶液,溶液褪色;
故答案为:酸性高锰酸钾溶液;溶液褪色.
点评 本题考查二氧化硫、氯气的性质,明确物质的性质及发生的化学反应是解答本题的关键,难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径:W>Y>Z | |
| B. | Z的单质不能与水反应 | |
| C. | 简单氢化物的沸点:W>Y | |
| D. | 最高价氧化物对应的水化物的酸性:X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 1:6:9 | C. | 1:3:4 | D. | 1:3:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.
某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:填空题
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
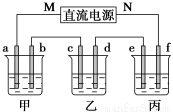
(1)接通电源,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_______________极;
②电极b上发生的电极反应为_______________;
③电极b上生成的气体在标准状况下的体积为_______________L;
④电极c的质量变化是__________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液______________;乙溶液_____________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com