
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是

A. 有O2放电的a极为电池的负极
B. O2-移向电池的正极
C. b极对应的电极反应为2H2-4e-+2O2-=2H2O
D. a极对应的电极反应为O2+2H2O+4e-=4OH-
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )

A.NaOH溶液可用于除去实验中多余的SO2
B.蓝色石蕊试纸先变红后褪色
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性强于I2
D.品红试纸、蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废渣中含NaCl、Mg ( OH) 2、CaCO3、BaCO3等,为实现变废为宝,设计了以下工艺流程制备七水硫酸镁。

在废渣中加入过量的稀硫酸,控制 pH为5.0,温度在52℃左右,用搅拌器持续搅拌。
(1)搅拌的作用是为使反应充分进行,其化学原理为_____________________________;
(2)经过分析,过滤所得滤液中含有的离子的主要为 Na+、Mg2+、H+、SO42-、Cl-,为了除去H+,最好加入适量的_____________________________ (填化学式)。
(3)蒸发浓缩器的溶液中主要含有氯化钠和硫酸镁,通入高温水蒸汽并控制温度在100 ~ 110℃,蒸发浓缩结晶,此时析出的晶体主要是氯化钠,说明此温度下硫酸镁的溶解度比氯化钠____________ (“大”或“小”)。 结晶槽中硫酸镁结晶的方法为_______________。
(5)为了检验所得 MgSO4·7H2O 是否纯净,具体的操作为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。

(1)由图中所给数据进行分析,该反应的化学方程式为 ;
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)= ;
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时 (填增大、减小或无变化,下同);混合气体密度比起始时 。
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X) = n (Y) = n (Z),则原混合气体中a : b = 。
(5)下列措施能加快反应速率的是 。
A.恒压时充入He B.恒容时充入He C.恒容时充入X D.及时分离出Z
E.升高温度 F.选择高效的催化剂
(6)下列说法正确的是 。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示。Z元素原子最外层电子数是内层电子总数的1/5。下列说法中正确的是
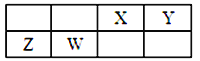
A. 原子半径由小到大的顺序为:X<Z<Y<W
B. Y元素最高价氧化物对应的水化物化学式为H3YO4
C. X、Z两种元素的氧化物中所含化学键类型相同
D. Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷元素在生产和生活中有广泛的应用
(1)P原子价电子排布图为_________。
(2)四(三苯基膦)钯分子结构如下图1:

P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为_________;判断该物质在水中溶解度并加以解释_________,该物质可用于图2所示物质A的合成:
物质A中碳原子杂化轨道类型为 _________;一个A分子中手性碳原子数目为 _________。
(3)在图3中表示出四(三苯基膦)钯分子中配位键:
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为_________;正四面体形阳离子中键角小于PCl3的键角原因为_________;该晶体的晶胞如右图4所示,立方体的晶胞边长为apm,NA为阿伏伽德罗常数的值,则该晶体的密度为_________g/cm3.
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图:

(1)为提高锌灰的浸取效率,不采用的方法是______________(填序号)
①研磨②搅拌③多次浸取④升高温度⑤加压
(2)步骤Ⅱ所得滤渣中的物质是______________(写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为______________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是______________;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取.化学反应方程式为______________。
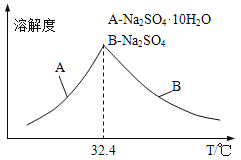
③已知Na2SO410H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO410H2O的操作方法是______________。
(5)若步骤Ⅱ加入的ZnCO3为bmol,步骤Ⅲ所得Cd为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可由N物质通过以下路线合成天然橡胶和香料柑青酸甲酯衍生物F。

已知:

(1)用系统命名法对N命名________.
(2)①试剂a的名称是________。②C→D中反应i的反应类型是________。
(3)E的结构简式是_____________。
(4)关于试剂b的下列说法不正确是________(填字母序号)。
a. 存在顺反异构体 b. 难溶于水c. 能发生取代、加成和氧化反应 d. 不能与NaOH溶液发生反应
(5)写出A生成B的反应方程式_________。
(6)分子中含有![]() 结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]某绿色农药结构简式为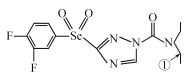 ,回答下列问题。
,回答下列问题。
(1)N元素的基态原子核外有_____种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是(按由大到小顺序排列)__________________(用元素符号回答,下同),基态硒原子的价层电子排布式为________________________。
(2)该物质中杂化轨道类型为sp2的原子有__________,分子内,分子中编号为①的碳原子和与其成键另外几个原子构成的空间结构为_____________。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH4<C2H6<CH3OH,其原因是_______________________________________,三种物质中属于极性分子的物质是__________,与CH4互为等电子体的一种微粒是______。
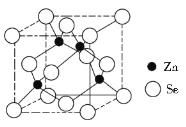
(4)硒化锌的晶胞结构如图所示,则硒的配位数为_______,若晶胞边长为d pm,设阿伏加德罗常数的值为NA,则硒化锌的密度为____________(不必化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com