
A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A形成的单质密度最小(相同条件下)。B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)元素C位于元素周期表的 周期 族,原子结构示意图为 。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是 (填化学式),BE4分子的空间构型是 。
(3)元素A与B形成原子个数比为1:1的相对分子质量最小的化合物的结构式为 。
(4)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒之间反应的其中一个化学方程式或离子方程式:
(5)写出E的单质制取漂白粉反应的化学方程式并标出电子转移的方向和数目:
(共16分)
(1)二 VA (2分)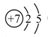 (2分),
(2分),
(2)H2O>NH3>CH4(2分) 正四面体(2分)
(3) 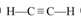 (2分)
(2分)
(4)NH3+H2O=NH3·H2O或OH- 十NH4+=NH3·H2O(2分)
(5)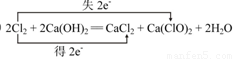 (化学方程式2分,电子转移2分,共4分)
(化学方程式2分,电子转移2分,共4分)
【解析】
试题分析:根据题意可以推断A、B、C、D、E分别为H、C、N、O、Cl。10个电子的离子可以以氖为中心,氖前面的阴离子和氖后面的阳离子以及阴离子对应的氢化物、氢化物的阴阳离子等。H、C、N、O想到CH4、NH3(NH2-、NH4+)、H2O(H3O+、OH-)、HF等。Cl2与漂白粉的反应为歧化反应,在表电子转移是最好使用单线桥法(参考答案以及2012安徽高考卷均使用双线桥法,不知何意)
考点:考查物质结构,涉及元素周期表结构、元素周期律、分子结构、氧化还原反应等相关知识。


科目:高中化学 来源: 题型:
容器温度 浓度 |
a容器 400℃ |
b容器 425℃ |
c容器 450℃ |
d容器 475℃ |
e容器 500℃ |
| c(O2) | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
| c(SO3) | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |

| c2(SO3) |
| c2(SO2)×c(O2) |
| c2(SO3) |
| c2(SO2)×c(O2) |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



| ①O3 | ②Zn,H2O |




查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com