
| A. | pH相同的①CH3COONa②NaHCO3③NaClO三份溶液中的c(Na+):②>③>① | |
| B. | 将0.5mol/L的Na2CO3溶液与amol/L的NaHCO3溶液等体积混合,c(Na+)<c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中离子浓度关系为:c(OH-)=c(CH3COO-)+2c(CH3COOH) | |
| D. | 25℃某浓度的NaCN溶液的pH=d,则其中又水电离出的c(OH-)=10-dmol/L |
分析 A.对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大;
B.根据物料守恒分析;
C.10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中溶质为等浓度的NaOH和CH3COONa,根据电荷守恒和物料守恒分析;
D.根据c(OH-)=$\frac{Kw}{c({H}^{+})}$计算.
解答 解:A.在相同的条件下测得①CH3COONa②NaHCO3③NaClO三种溶液pH相同,已知酸性:CH3COOH>H2CO3>HClO,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,即溶液中的c(Na+):①>②>③,故A错误;
B.在NaHCO3溶液中存在物料守恒c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),由于溶液中还有Na2CO3,所以c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3),故B错误;
C.10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中溶质为等浓度的NaOH和CH3COONa,溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),物料守恒为c(Na+)=2c(CH3COO-)+2c(CH3COOH),则c(OH-)=c(CH3COO-)+2c(CH3COOH),故C正确;
D.25℃某浓度的NaCN溶液的pH=d,则c(OH-)=$\frac{Kw}{c({H}^{+})}$=10d-14mol/L,盐溶液中氢离子和氢氧根离子均由水电离,所以c(OH-)=10d-14mol/L,故D错误.
故选C.
点评 本题考查酸碱混合溶液中离子浓度大小的比较,明确酸碱混合后溶液中的溶质及量的关系是解答本题的关键,并利用电离、水解、电荷守恒、物料守恒等知识来解答,题目难度中等.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | N、P、O | B. | Li、Be、Mg | C. | C、N、P | D. | O、C、F |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
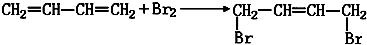

 ;C
;C .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁原子的价电子数比铝少 | |
| B. | 镁遇冷浓硝酸和硫酸,表面不能钝化,而铝均能 | |
| C. | 镁带能在空气中和在盛CO2的集气瓶里燃烧,而铝箔均不能 | |
| D. | 铝的硬度、延展性、熔点均比镁大、好、高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是原子的实际质量 | B. | 是质子数加中子数 | ||
| C. | 标准是碳-12原子质量的$\frac{1}{12}$ | D. | 相对原子质量的单位是Kg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com