
下列排列顺序正确的是:( )
① 热稳定性:H2O>HF>H2S ② 原子半径:Na>Mg>O ③ 酸性:H3PO4>H2SO4>HClO4④ 非金属性:S>O>F ⑤碱性:NaOH>Mg(OH)2>Al(OH)3
A. ①③ B. ②⑤ C. ①④ D. ②③
科目:高中化学 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:实验题
(Ⅰ)某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L﹣1盐酸、0.55mol•L﹣1NaOH溶液,实验尚缺少的玻璃用品是_______.
(2)已知:反应后溶液的比热容c为4.18J·℃﹣1•g﹣1,0.5mol•L﹣1盐酸和0.55mol·L﹣1NaOH溶液的密度均为1g·cm﹣3.实验时记录的实验数据如下:
实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=____________(保留两位小数)
②已知:CH3COOH(aq) CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COOH(aq)+OH-(aq)= CH3COO-(aq)+H20(l) △H3 则△H3_____△H1(填“>”、“<”、“=”)
(Ⅱ)某实验小组利用硫酸酸化的KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
(3)上述反应的离子方程式为______________________________________
(4)t1_____ t2(填“>”、“<”、“=”),其理由是__________________
(5)实验②和实验③两组实验的目的是______________________________
(6)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:__________________(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是______。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
查看答案和解析>>
科目:高中化学 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. NaHCO3溶液与过量的澄清石灰水反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
B. 用食醋除去热水瓶水垢中CaCO3:CaCO3+2H+=Ca2++CO2↑+H2O
C. 向氢氧化钡溶液中滴加足量稀硫酸:Ba2++OH-+SO42 -+H+=BaSO4↓+H2O
D. 金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源:福建省2016-2017学年高一3月月考化学试卷 题型:填空题
完成下反应的化学方祝式或离子方程式:
(1)铝与黑色铁的化合物(有磁性)反应_____________。
(2)工业上制粗硅的反应____________。
(3)硫酸铝溶液中加入过量氨水的离子方程式____________。
(4)用稀盐酸清洗铜器皿表面上的铜锈的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源:福建省2016-2017学年高一3月月考化学试卷 题型:选择题
将过量的CO2分别通入①CaCl2溶液,②Na2SiO3溶液,③Ca(ClO)2溶液,④饱和Na2CO3溶液,最终有沉淀析出的是( )
A.①②③④ B.②④ C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学基础】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):


根据以上信息回答下列问题:
(1)烃A的结构简式是 。
(2)①的反应条件是 。②的反应类型是 。
(3)下列对抗结肠炎药物有效成分可能具有的性质推测正确的是: 。
A.水溶性比苯酚好,密度比苯酚的大 |
B.能发生消去反应 |
C.能发生聚合反应 |
D.既有酸性又有碱性 |
(4)E与足量NaOH溶液反应的化学方程式是 。
(5)写出所有符合下列条件的E的同分异构体的结构简式: 。
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知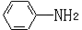 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物 的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A. 在光照条件下,体积比为1:1的CH4和Cl2充分反应可以制取CH3Cl
B. 乙烯和聚乙烯都可与溴水发生加成反应
C. 按系统命名法, 的名称为2,7,7-三甲基-3-乙基辛烷
的名称为2,7,7-三甲基-3-乙基辛烷
D. 分子式同为C3H7Cl,但沸点不同的分子共有两种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
(11分)运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:
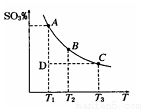
①2SO2(g)+O2(g) 2SO3(g)的△H________0(填“>”或“<”),
2SO3(g)的△H________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是________。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省沙市高一下学期第三次双周考(A卷)化学试卷(解析版) 题型:选择题
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
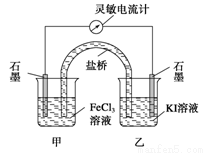
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com