


科目:高中化学 来源: 题型:
| A、常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA |
| B、标准状态下,11.2 L氯气含有分子数为0.5 NA |
| C、0.1 mol?L-1的硫酸铝溶液所含的SO42-数就是0.3NA |
| D、NA个He分子所具有的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A、离子半径大小:R3+<X+<M2- |
| B、Y与M组成的化合物是光化学烟雾的原因之一 |
| C、将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 |
| D、M氢化物的熔沸点高于Z氢化物的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
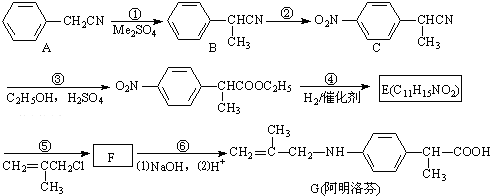
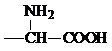 ②含有对位二取代苯环
②含有对位二取代苯环| 浓硫酸 |
| 170℃ |
| Br2 |
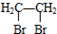
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ |
| B、向含有0.2 mol FeI2的溶液中通入0.25 mol Cl2:8I-+2Fe2++5Cl2═10Cl-+4I2+2Fe3+ |
| C、K37ClO3与浓盐酸(HCl)在加热时生成Cl2:37ClO3-+6HCl═37Cl-+3Cl2↑+3H2O |
| D、将0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
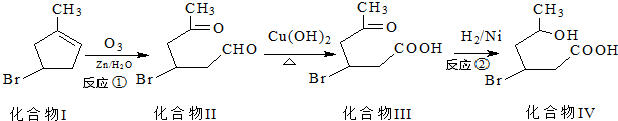
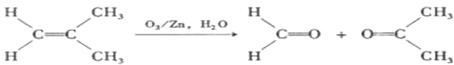
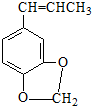 )发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
)发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
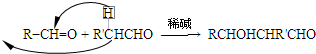
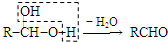
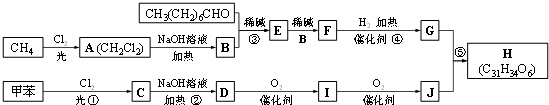
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Cl-、CH3COO-、NO3- |
| B、K+、AlO2-、NO3-、OH- |
| C、Fe3+、I-、SO42-、H+ |
| D、AlO2-、HCO3-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
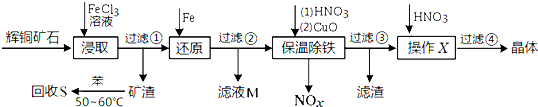
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com