
| A. | 1 mol Mg 原子变成 Mg2+时失去的电子数为2 NA | |
| B. | 标准状况下,11.2 L H2O所含的电子数为5 NA | |
| C. | 常温常压下,16g O2 与16gO3含有的原子数为相同 | |
| D. | 0.1 mol/L K2SO4 溶液中含有 K+为0.2 NA |
科目:高中化学 来源: 题型:选择题
| A. | 纯净的氢气在氯气里安静地燃烧,发出苍白色火焰 | |
| B. | 氢气与氯气反应生成的氯化氢气体与空气里的水蒸气结合,呈白雾状 | |
| C. | 氢气与氯气混合后,光照发生爆炸 | |
| D. | 氢气与氯气的反应是化合反应,是氧化还原反应,且有电子得失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
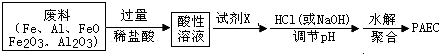
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com