
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是
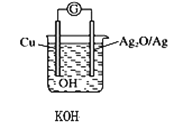
A.2molCu与1 molAg2O的总能量低于1 molCu2O与2molAg具有的总能量
B.负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C.测量原理示意图中,电流方向从Cu流向Ag2O
D.电池工作时,OH-向Ag电极移动
【答案】B
【解析】
由电池反应方程式2Cu+Ag2O=Cu2O+2Ag知,较活泼的金属铜失电子发生氧化反应,所以铜作负极,较不活泼的金属银作正极,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;根据原电池的构成条件之一为自发的放热的氧化还原反应分析反应物与生成物的总能量大小。
A. 因为原电池的构成条件之一为自发的放热的氧化还原反应,所以该反应为放热反应,则2molCu与1 molAg2O的总能量高于1 molCu2O与2molAg具有的总能量,A项错误;
B. 负极发生失电子的氧化反应,电极反应为2Cu+2OH--2e-=Cu2O+H2O,B项正确;
C. 测量原理示意图中,电流方向从正极流向负极,即从Ag2O流向Cu,C项错误;
D. 原电池工作时,阴离子向负极移动,阳离子向正极移动,即OH-向Cu电极移动,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2其原理如图所示,正确的是( )
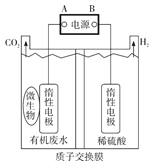
A. 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小
B. 电源A极为负极
C. 通电后,若有22.4LH2生成,则转移2mol电子
D. 与电源A极相连的惰性电极上发生的反应为CH3COOH-8e-+2H2O=2CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(仅含三种短周期元素)是一种络合氢化物的储氢材料,在400℃下分解,放出氢气。X中某种元素的单质常用来制造信号弹和烟火,某研究小组为了探究A的组成和性质,设计并完成了如下实验。(金属互化物--全部由金属元素组成的化合物)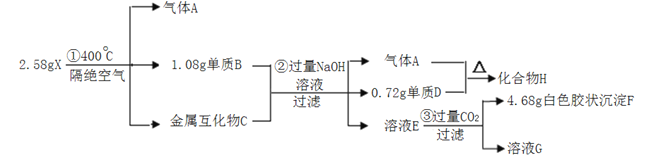
(1)写出单质D对应的阳离子结构示意图:_____。
(2)X在400℃下分解的化学方程式:_____。
(3)写出单质B与NaOH溶液反应的离子方程式:____。
(4)化合物H___(填“可能”或“不可能”)与水发生反应产生H2,判断理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,现有如下图中物质的转化关系,

试回答:(1)写出B的化学式________D的化学式_________,G俗称___________
(2)写出④的化学方程式_________________________________________
(3)写出⑥的离子方程式__________________写出⑦的离子方程式_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 是中学化学中的常见气体,也是大气污染物的主要组成成分。回答下列问题:

⑴甲组同学利用下列装置制备并收集干燥的 SO2:

装置Ⅰ中盛装亚硫酸钠的仪器名称是_______,装置 II 的作用是对 SO2 气体进行干燥,该装置中所盛 试剂名称为_________,装置 III 为集气装置,应选取填入 III 中的集气装置为___________(选填字母代号)。
⑵乙组同学利用下列装置制备 SO2 并探究其性质:

①该组同学的实验装置中,依次连接的合理顺序为a→_________。装置C中饱和NaHSO3溶液的作用是________。
②能证明SO2具有还原性的现象是___________,该反应的离子方程式为_________________。
③装置B的作用吸收SO2尾气,该装置中盛装的试剂是_______________。
⑶设计实验证明H2SO3为弱电解质:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
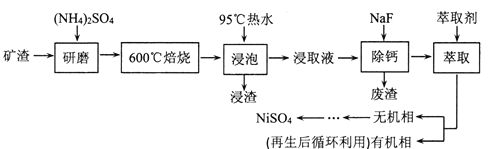
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
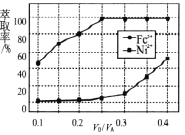
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。
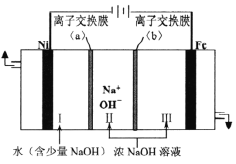
①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com