
无水氯化铝是一种重要韵催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g) 4AlCl3(g)+3O2(g)△H>0.下列分析错误的是()
4AlCl3(g)+3O2(g)△H>0.下列分析错误的是()
A. 增大反应体系的压强,反应速率可能加快
B. 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C. 电解熔融的Al2O3和AlCl3溶液均能得到单质铝
D. 将AlCl3•6H2O在氯化氢气流中加热,也可制得无水氯化铝
考点: 化学平衡的影响因素;化学反应速率的影响因素.
专题: 化学平衡专题.
分析: A、增大压强对有气体参加的反应会增大反应速率;
B、反应是吸热反应;
C、氯化铝是共价化合物不能熔融电解生成铝;
D、氯化铝在水溶液中加热会水解,加入氯化氢气体会抑制氯化铝的水解.
解答: 解:A、增大反应体系的压强,反应速率加快,故A正确;
B、加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且吸收热量,故B错误;
C、氯化铝是共价化合物不能熔融电解生成铝,可以电解熔融氧化铝制备金属铝,故C错误;
D、氯化铝在水溶液中加热会水解,加入氯化氢气体会抑制氯化铝的水解;应将AlCl3•6H2O在氯化氢气流中加热,也可制得无水氯化铝,故D正确;
故选BC.
点评: 本题考查了化学平衡的影响因素分析判断,反应热量变化,电解制备铝的工业方法和氯化铝溶液蒸发结晶的方法分析,题目难度中等.


科目:高中化学 来源: 题型:
一般情况下胶体稳定,胶体微粒不易聚集,主要原因是( )
A.胶体有丁达尔现象
B.胶体有布朗运动
C.胶体微粒因吸附带电荷离子而带电,带同种电荷的微粒间相互排斥
D.胶体微粒直径在1~100nm之间,微粒小,不受重力作用
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列各组物质 ①O2和O3 ②12C和14C ③CH3CH2CH2CH3和(CH3)2CHCH3
④干冰和SiC ⑤金刚石和SiO2
它们的晶体属于分子晶体的是 ,互为同位素的是 ,属于原子晶体的是 .
(2)配离子[TiCl(H2O)5]2+的中心离子的符号为 ,配位数为 .
(3)写出下列方程式
①甲酸(HCOOH)与甲醇(CH3OH)在浓硫酸加热条件下发生酯化反应的化学方程式
②苯与液溴在溴化铁催化剂下反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是()
A. 1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B. 常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数为3NA
C. 0.1 mol•L﹣1 NaF溶液中,HF和F﹣总和为0.1NA个
D. 12.5 mL 16 mol•L﹣1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)⇌2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示.
压强/MPa
体积分数/%
温度/℃ 1.0 2.0 3.0
810 54.0 a b
915 c 75.0 d
1000 e f 83.0
①b<f ②915℃、2.0MPa时E的转化率为60%
③该反应的△S>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有()
A. 4个 B. 3个 C. 2个 D. 1个
查看答案和解析>>
科目:高中化学 来源: 题型:
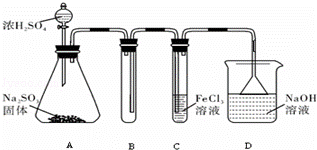
某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 ,操作中不需要的仪器有 (填字母).
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时C中观察到的现象为 ,
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成取 ;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣.该做法 (填“合理”或“不合理”),理由是 .
(4)D装置中倒置漏斗的作用是 .
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有 (填入正确选项前的字母).
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原子序数11~17的元素,自钠到氯,电子层数相同,最外层电子数从 增加到 ,随着核电荷数依次递增,原子半径依次 ,核对外层电子的引力逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,因此,金属性逐渐 ,非金属性逐渐 .
(2)元素金属性的强弱,可以从它的单质与水或酸的反应置换氢的 程度,以及它的最高价氧化物的水化物的 强弱来判断.元素非金属性的强弱,可以从它的最高价氧化物的水化物的 强弱,或它的单质跟氢气生成气态氢化物的 及氢化物的 来判断.
(3)元素的性质随着原子序数的递增而呈 的变化,这个规律叫做元素周期律.
查看答案和解析>>
科目:高中化学 来源: 题型:
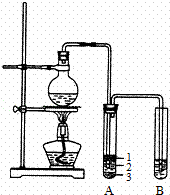
实验室制取少量溴乙烷的装置如右图所示.根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、 和1:1的硫酸.配制体积比1:1的硫酸所用的定量仪器为 (选填编号).
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式 .
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是 .
试管A中的物质分为三层(如图所示),产物在第 层.
(4)试管A中除了产物和水之外,还可能存在 、 (写出化学式).
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 (选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是 .
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com