
X~R是元素周期表中的短周期元素,其性质或结构信息如下表:
|
元素 |
X |
Y |
Z |
W |
R |
|
性质信息 |
能形成+7价的化合物 |
日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 |
通常状况下能形成短周期中最稳定的双原子分子 |
焰色反应为黄色 |
位于第IVA,是形成化合物种类最多的元素 |
请用化学用语回答下列问题:
(1)X在元素周期表中的位置是_______。
(2)元素W的离子结构示意图为_________。
(3)元素R的最高价氧化物的电子式为_________。
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为_________,将A 溶于水,其水溶液中离子浓度由大到小的顺序是_______________ 。
(5)含Y的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是 。(用离子方程式表示)
(6)W的氢氧化物是重要的基本化工原料。写出工业上制取该氢氧化物的离子反应方程式__________ 。
(共11分)
(1)第三周期ⅦA族 (2分);
(2)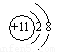 (1分)
(1分)
(3)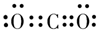 (1分)
(1分)
(4)离子键、(极性)共价键 (各1分);
c(Cl-) >c(NH4+) >c(H+)> c(OH-) (1分)
(5)Al3++3H2O Al(OH)3+3H+ (2分);
Al(OH)3+3H+ (2分);
(6)2Cl-+2H2O H2↑+Cl2↑+2 OH-(2分)。
H2↑+Cl2↑+2 OH-(2分)。
【解析】
试题分析:
(1)X~R是元素周期表中的短周期元素,能形成+7价的化合物,X为Cl;
Y为短周期元素;日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着;Y为Al
Z为短周期元素,通常状况下能形成短周期中最稳定的双原子分子,Z为N
W为短周期元素,焰色反应为黄色,W为Na
R为短周期元素,位于第IVA,是形成化合物种类最多的元素,R为C
(3)R元素R的最高价氧化物为CO2
(4)HCl和NH3生成NH4Cl;含离子键、(极性)共价键,NH4Cl溶液酸性,c(Cl-) >c(NH4+) >c(H+)> c(OH-)。
(6)电解NaCl溶液来制NaOH。
考点:本题以元素推断为基础,考查物质结构、离子浓度比较、化工生产等知识。


科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.160 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | |||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 六种元素中原子半径最大 | 次外层电子数是最外层电子数的4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com