
2014年7月和12月山西大学分子科学研究所翟华金教授、李思殿教授与清华大学李隽教授、美国布朗大学Lai-Sheng Wang教授及复旦大学刘智攀教授课题组合作,首次合成“中国红灯笼分子”——硼球烯B40。B40是继C60之后第二个从实验和理论上完全确认的无机非金属笼状团簇。
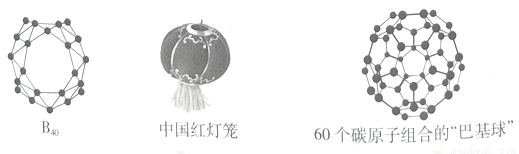
(1) 基态硼原子的外围电子排布式为___________,碳60中碳原子杂化方式为____________。
(2)构成碳60晶体的作用力是___________________。
⑶与硼同周期但第一电离能比硼大的元素有___________种。
(4)磷化硼(BP)是由硼元素与磷元素组成的无机化合物,属于一种半导体材料。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。BP晶胞中B采用面心立方堆积,P原子填入四面体空隙中。
①写出三溴化硼和三溴化磷的空间构型:
三溴化硼__________;三溴化磷____________。
②磷化硼晶体内微粒间的作用力有__________。
③计算磷化硼中硼原子和磷原子之间的最近距离(晶胞参数为478pm)____________ 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年河北省张家口市高二上学期期末考试化学试卷(解析版) 题型:简答题
环境监测显示,某地市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知: ΔH=241.8kJ·mol-1,
ΔH=241.8kJ·mol-1,
 ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1
写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________。
(2)汽车尾气中NO是在发动机汽缸中生成的,反应为N2(g)+O2(g) 2NO(g) ΔH>0。
2NO(g) ΔH>0。
①将含0.8molN2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO。计算该温度下此反应的化学平衡常数K=________(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,原因是________.
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。
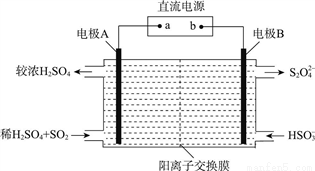
①电极A的电极反应式为________;
电极B的电极反应式为________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省张家口市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列物质能在空气中稳定存在的是
A. 氢氧化亚铁悬浊液 B. 氧化钠
C. 二氧化硅 D. 氯水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(文)化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A. 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2O
B. 铁与稀盐酸混合:2Fe+6H+=2Fe3++3H2 ↑
C. 铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag
D. 稀硝酸滴在石灰石上:CaCO3+2H+=Ca2++H2CO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(文)化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 摩尔是国际单位制七个基本物理量之一
B. 1 L 0.1 mol/L BaCl2溶液中所含的Cl-为0.1 NA
C. 常温常压下,11.2 L Cl2所含的分子数为0.5 NA
D. 常温常压下,32 g O2含有的氧原子数为2 NA
查看答案和解析>>
科目:高中化学 来源:2017届山西省名校高三下学期联考理综化学试卷(解析版) 题型:选择题
M、N、Q、R为原子序数依次增大的短周期主族元素,N是形成有机物基本骨架的元素,M与N、Q可分别形成共价化合物S、T,且S、T分子中含相同的电子数。金属单质R在Q的单质中燃烧生成的化合物W可与T发生氧化还原反应。下列说法正确的是
A. 原子半径大小:M<N<Q<R
B. W中的阴阳离子个数比为1:1,属于离子化合物
C. Q的某单质可作水的消毒剂,该单质在大气中含量越多,对人体越有益
D. M和N、Q均能形成既含极性键又含非极性键的分子
查看答案和解析>>
科目:高中化学 来源:浙江省台州市2017届高三2月选考科目教学质量评估测试化学试卷 题型:简答题
某研究性小组用含铬废水制取具有强氧化性的重铬酸钾(K2Cr2O7),实验方案如下:

已知:
①Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
②金属离子沉淀的PH如下:
离子 | 开始沉淀的PH | 沉淀完全的PH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 4.1 |
③不同温度下化合物的溶解度如下:
物质 | 溶解度/(g/110g水) | ||
0℃ | 40℃ | 80℃ | |
K2SO4 | 7.4 | 14.8 | 21.4 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
请回答:
(1)操作A的名称是____,加入硫酸的目的是_____。
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式________。
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥。则下列说法正确的是__________。
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可用摩尔盐[(NH4)2SO4·FeSO4·6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作__________。
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如下:
实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 24.98 |
2 | 25.00 | 1.56 | 29.30 |
3 | 25.00 | 1.00 | 26.02 |
则测得K2Cr2O7产品的纯度是_________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源:浙江省台州市2017届高三2月选考科目教学质量评估测试化学试卷 题型:选择题
X、Y、Z、W四种短周期主族元素,其中W是非金属性最强的元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 四种元素的单质中,W的氧化性最强
B. Z元素的气态氢化物稳定性比W弱
C. Y元素的氧化物对应水化物的酸性一定比Z弱
D. X、Z元素能形成化学式为XZ2的化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温常压,11.2 L NO和O2混合气体的原子数为NA
B. 1.5 g甲基所含有的电子数目为0.9NA
C. 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA
D. 7.8g苯中碳碳双键的数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com