
下列关于化学平衡常数的说法正确的是( )
| A.化学平衡发生移动,平衡常数必发生变化 |
| B.平衡常数发生变化,化学平衡必发生移动 |
| C.改变浓度,平衡常数一定改变 |
| D.催化剂改变达到平衡的时间,必引起平衡常数的改变 |
科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是 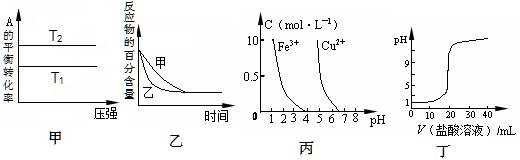
A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0 2C(g)的△H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,反应A2(g)+B2(g)??2AB(g)达到平衡的标志是( )
| A.单位时间内生成n mol A2的同时生成n mol AB |
| B.容器内的总压强不随时间的变化而变化 |
| C.单位时间内生成2n mol AB的同时生成n mol B2 |
| D.单位时间内生成n mol A2的同时生成n mol B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图(2)所示。
则下列结论正确的是
| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1 |
B.容器中发生的反应可表示为3X(g)+Y(g)  2Z(g) 2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图(3)所示,则改变的条件是增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ |
| C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在某密闭容器中,可逆反应:A(g)+B(g) xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )
xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )
| A.p3>p4,y轴表示A的转化率 |
| B.p3>p4,y轴表示B的质量分数 |
| C.p3>p4,y轴表示C的质量分数 |
| D.p3>p4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
[双选题]可逆反应2A(g)+B(g) 3C(?)+D(?) ΔH<0,其他条件不变,随着温度的降低,混合气体平均相对分子质量有变小的趋势,则下列判断正确的是( )
3C(?)+D(?) ΔH<0,其他条件不变,随着温度的降低,混合气体平均相对分子质量有变小的趋势,则下列判断正确的是( )
| A.C和D可能都是固体 |
| B.C和D一定都是气体 |
| C.若D为固体,则C一定是气体 |
| D.C和D可能都是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25 ℃、1.01×105 Pa下,反应2N2O5(g) 4NO2(g)+O2(g) ΔH="+56.7" kJ·mol-1能自发进行的合理解释是( )
4NO2(g)+O2(g) ΔH="+56.7" kJ·mol-1能自发进行的合理解释是( )
| A.该反应是分解反应 |
| B.该反应的熵增效应大于焓变效应 |
| C.该反应是熵减反应 |
| D.该反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com