


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
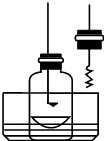 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 | 均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
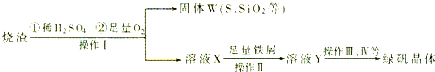
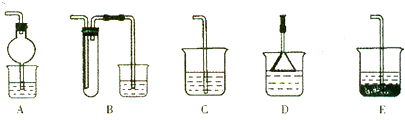
 +8H+═5Fe3++Mn2++4H2O)
+8H+═5Fe3++Mn2++4H2O)查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将淀粉水解,并用新制的氢氧化铜悬浊液检验其水解产物的实验中,要进行的主要操作是:
①加热;②滴入稀硫酸;③加入新制的氢氧化铜悬浊液;④加入足量的氢氧化钠溶液.
以上各步操作的先后顺序排列正确的是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com