
| A. | $\frac{16n}{3m-2n}$ | B. | $\frac{32n}{n-m}$ | C. | $\frac{32m}{3n-2m}$ | D. | $\frac{32n}{3n-2m}$ |
分析 一个SO2分子的质量为n kg,一个SO3分子的质量为m kg,则一个O原子的质量为(m-n)kg,再结合一个SO2分子的质量或一个SO3分子的质量,可知1个S原子的质量,SO2的相对分子质量=$\frac{1个S{O}_{2}分子质量}{1个S原子质量×\frac{1}{32}}$.
解答 解:一个SO2分子的质量为n kg,一个SO3分子的质量为m kg,则一个O原子的质量为(m-n)kg,由一个SO2分子的质量为n kg,可知1个S原子的质量为n kg-2(m-n)kg=(3n-2m)kg,以硫原子质量的$\frac{1}{32}$作为相对原子质量的标准,则SO2的相对分子质量为$\frac{nkg}{\frac{1}{32}×(3n-2m)kg}$=$\frac{32n}{3n-2m}$,
故选:D.
点评 本题考查相对分子质量计算,关键是对相对分子质量的理解,题目难度不大.


科目:高中化学 来源: 题型:选择题
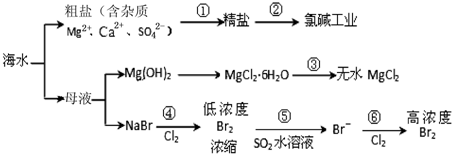
| A. | 除去粗盐中杂质(Mg2+、Ca2+、SO42-),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 | |
| D. | 从第④步到第⑥步的目的是为了浓缩富集溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径由大到小的顺序:X、Y、Z、W | |
| B. | 元素最高正价由低到高的顺序:X、Y、Z、W | |
| C. | 简单氢化物的热稳定性由弱到强的顺序:Y、Z、W | |
| D. | 最高价氧化物的水化物的酸性由弱到强的顺序:X、Y、Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+ )=c(X-)>c(OH-)=c(H+) | |
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | II A | III A | IV A | VA | VI A | VII A |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,用细沙覆盖灭火,镁着火用泡沫灭火器 | |
| B. | 用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则待测结果会偏低 | |
| C. | 测定一包白色粉末的质量,将药品放在右盘,砝码放在左盘 | |
| D. | 除去乙醇中的乙酸可先加入碳酸钠溶液然后蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com