
硫酸亚铁是生产钛白的副产品,价格低,以琉酸亚铁为原料制备高效净水剂高铁酸钾 (K2FeO4)可大大降低成本。其生产工艺如下:
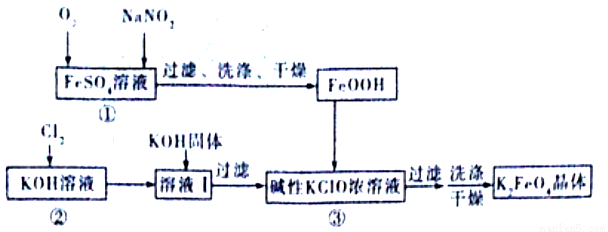
已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请问答下列问题:
(1)铁黄(FeOOH)中铁元素的化合价是_______。写出反应①生成铁黄(FeOOH)的离子方程式:_______,在通入O2“氧化”FeSO4的过程中,溶液的pH_____(填“增大”“减小”或“不变”)
(2)“过滤、洗涤、干燥”制备铁黄时,检验铁黄表面已洗涤干净的操作是______________。
(3)写出反应③的化学方程式:___________________。
(4)在溶液I中加KOH 固体的目的是__________________。
(5)K2FeO4可作为新型多功能水处理剂的原因是________________。
(6)该工艺每消耗标准状况下112LCl2理论上得到_______g K2FeO4。
科目:高中化学 来源:2017届北京市朝阳区高三第一次(3月)综合练习理综化学试卷(解析版) 题型:推断题
用于汽车刹车片的聚合物Y是一种聚酰胺纤维,合成路线如下:

已知:
(l)生成A的反应类型是________。
(2)试剂a是____。
(3)B中所含的官能团是____。
(4)W、D均为芳香化合物,分子中均只含两种不同化学环境的氢原子。
①F的结构简式是____。②“F→X”的反应中,除X外,另外一种产物是__________。
③生成聚合物Y的化学方程式是__________。
(5)只以CH2=CH-CH=CH2为有机原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源:四川省成都市北湖校区2016-2017学年高一3月月考化学试卷 题型:选择题
X、Y、Z和W代表原子序数依次增大的四种短周期元素,X的一种常见核素原子核内没有中子,在周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17。则下列有关叙述正确的是( )
A. Y、Z和W三种元素可能位于同一周期
B. Y和W所形成的含氧酸均为强酸
C. X、Y、Z和W可以X5YZ4W的离子化合物
D. 上述元素形成的简单氢化物中,W的氢化物相对分子质量最大,Y的氢化物最稳定
查看答案和解析>>
科目:高中化学 来源:2017届全国新课程高考仿真信息理综(一)化学试卷(解析版) 题型:填空题
SO2是常见的大气污染物,燃煤是产生SO2的主要原因。工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。该反应的化学方程式是 。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
① 分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHSO3时,两种吸收液体积比V(Na2SO3):V(NaOH)= 。
② NaOH溶液吸收了足量的SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是 。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。为此甲同学设计如下实验(夹持装置和加热装置略,气密性已检验):


已知:Na2SO3(固体) + H2SO4(浓)  Na2SO4 + SO2↑+ H2O
Na2SO4 + SO2↑+ H2O
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。甲认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2吸收液。
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
① A中产生的白雾是浓硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
② 。
为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去。
③试管B中试剂是 溶液;滴加浓硫酸之前的操作是 。
④通过甲乙两位同学的实验,得出的结论是 。
查看答案和解析>>
科目:高中化学 来源:2017届全国新课程高考仿真信息理综(一)化学试卷(解析版) 题型:选择题
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W2-和X+离子的电子层结构相同,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. W、X形成的化合物只含有离子键 B. 原子半径:Y>Z>W
C. 还原性:W2->Y2- D. 氧化物的水化物的酸性:Y<Z
查看答案和解析>>
科目:高中化学 来源:安徽省皖北协作区2017届高三第19届(3月)联考理综化学试卷 题型:选择题
一种三室微生物电池污水系统原理如下图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是

A. 该装置为原电池,b是原电池的负扱
B. 中间室:Na+移向右室,Cl-移向左室,a极区溶液的pH滅小
C. b极反应式为2NO3- -10e-+12H+=N2↑+6H2O
D. 当左室有4.48LCO2(标准状况下)生成时,右室产生N2的物质的量为0.8mol
查看答案和解析>>
科目:高中化学 来源:2017届高考信息卷(全国卷I)理科综合(一)化学试卷(解析版) 题型:填空题
铁及其化合物在日常生活中有广泛的应用,回答下列问题。
(1)FeC13具有净水作用,但腐蚀设备,FeC13溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)_________。
(2)为节约成本,工业上用NaC1O、氧化酸性FeCl2废液得到FeC13,完成NaClO3氧化FeCl2的离子方程式:___________。
口ClO3-+口Fe2++口_____=口Cl-+口Fe3++口_______。
(3)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、助凝、杀菌、除臭为一体的新型高效多功能绿色水处理剂,具有良好的应用前景。其生产工艺如图1所示:

①实验室模拟工业流程中过滤操作用到的主要玻璃仪器有______。
②在“反应液I”中加KOH固体的目的有两个,a是与“反应液I”中过量的Cl2继续反应,生成更多的KClO, b是_____。
③用K2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是______(用离子方程式表示)。
(4)从环境保护的角度看,制备K2FeO4较好的方法未电解法,其装置如图2所示。

电解过程中阳极电极反应式为________。
(5)钢铁腐蚀造成很大损失,有资料显示,全世界每年由于腐蚀二造成的报废的钢铁高达总产量的三分之一。防止钢铁腐蚀有很多措施,用图3装置防止钢铁腐蚀(烧杯中均为食盐水), X 极的电极材料应是______(填字母)。
A.锌 B.铜 C.银 D.石墨
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高一3月月考化学试卷(解析版) 题型:选择题
下列每组物 质中含有的化学键类型相同的是( )
质中含有的化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH B.Cl2、Na2S、HCl、SO2
C.HBr、CO2 、H2O、CS2 D.Na2O2、H2O2、H2O、O3
查看答案和解析>>
科目:高中化学 来源:2017届天津市部分区高三质量调查(一)化学试卷(解析版) 题型:推断题
甲苯可用于合成治疗粘膜溃疡、创面等的镇痛药物苯佐卡因及食用香料F,其合成路线如下:
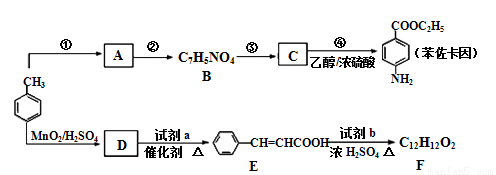
已知:

④苯环上发生取代反应规律:当苯环碳原子连有甲基时,主要在其邻位或对位上引入官能团;当苯环碳原子连有羧基时,主要在其间位上引入官能团。
请回答下列问题:
(1)B分子中含氧官能团的名称是_______;试剂a的结构简式为________。
(2)下列关于苯佐卡因合成路线的说法中错误的是________(填字母)
a.步骤①和②可以互换
b. 反应①、④属于取代反应
c.反应①的条件为酸性高锰酸钾溶液
d.反应①除主要生成A外,还可能生成 、
、
(3)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,b的化学名称是______,写出E与试剂b生成F的化学方程式__________。
(4)E有多种同分异构体,符合下列条件的有________种。
①苯环上有三个取代基;②能发生银镜反应,且1 mol该有机物生成4 mol Ag
写出其中一种核磁共振氢谱有4组吸收峰,且峰面积之比为1∶2∶2∶3的有机物的结构简式___________。
(5)参照上述合成路线及信息,根据已有知识,完善下列以甲苯为主要原料制备有机物(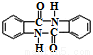 )的合成路线_________(无机试剂任选)。
)的合成路线_________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com