
| A. | 集气瓶中气体的颜色不变 | B. | 集气瓶中有火星出现 | ||
| C. | 集气瓶内壁上有油状液体出现 | D. | 集气瓶口有棕黄色烟出现 |
分析 氯气为黄绿色气体,甲烷和氯气在光照条件下现象为气体颜色变浅,有油状小液滴生成,打开试管塞试管口有白雾.
解答 解:A.随反应进行,氯气的浓度减小,试管中气体的黄绿色变浅,故A错误;
B.反应过程中试管中无火星出现,故B错误;
C.甲烷与氯气在光照的条件下,甲烷中H原子被氯原子取代生成一氯甲烷、二氯甲烷、三氯甲烷、三氯甲烷,其中只有一氯甲烷是气体,其余三种为液体,试管壁上有油状液滴(二氯甲烷、三氯甲烷与四氯甲烷)出现,故C正确;
D.反应有氯化氢生成,氯化氢极易溶于水,故试管口有白雾,故D错误;
故选C.
点评 本题考查烷和氯气反应的现象,题目难度不大,平时注意知识的积累,注意掌握常见有机物的结构及具有的化学性质.


科目:高中化学 来源: 题型:解答题
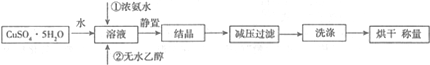

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(Cl-)>c(H+)>c(NH4+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | D. | c(OH-)>c(H+)>c(Cl-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
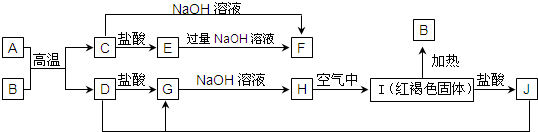
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
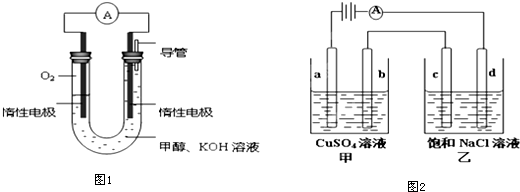
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: | |
| C. | 乙醇的分子式C2H6O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 准确称量一定质量的黑色粉末,用H2充分还原,并用干燥剂收集所得的水,获得水的准确质量,进行计算 | |
| B. | 准确称量一定质量的黑色粉末,溶解于足量盐酸,加热蒸干溶液并在空气中灼烧至质量不变,称量所得粉末质量,进行计算. | |
| C. | 准确称量一定质量的黑色粉末,用CO充分还原,在CO气流中冷却后准确称量剩余固体的质量,计算. | |
| D. | 准确称量一定质量的黑色粉末,与一定质量铝粉混合后点燃,充分反应后冷却,准确称量剩余固体质量,进行计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com