
����Ŀ��������������������ͭ���Ǻ�ɫ��ĩ�����������ϣ�ijУһ��ѧʵ��С��ͨ��ʵ����̽��һ��ɫ��ĩ��Fe2O3��Cu2O�������̽���������£�
�������ϣ�Cu2O��һ�ּ������������ϡ��������Cu��CuSO4�� Cu2O�ڿ����м�������CuO
��������衿
����1����ɫ��ĩ��Fe2O3
����2����ɫ��ĩ��Cu2O
����3����ɫ��ĩ��Fe2O3��Cu2O�Ļ����
�����̽��ʵ�顿
ȡ������ĩ��������ϡ�����У���������Һ���ٵμ� KSCN �Լ���
��1��������1��������Ԥ��ʵ��������_________��
��2�����μ� KSCN �Լ�����Һ�����ɫ����֤��ԭ�����ĩ��һ����������������������Ϊ����˵��������___________��
��3���������ĩ��ȫ�ܽ�������ڣ��μ� KSCN �Լ�ʱ��Һ�����ɫ����֤������________������д��������Ӧ���������ӷ���ʽ____________________��
��̽�����졿
��ʵ�������ȷ����ɫ��ĩΪFe2O3��Cu2O�Ļ���
��4��ʵ��С�����ü��ȷ��ⶨCu2O������������ȡa g�����ĩ�ڿ����г�ּ��ȣ����������ٱ仯ʱ����������Ϊbg(b��a)����������Cu2O����������Ϊ________________��
��5�������ú�ɫ��ĩFe2O3��Cu2O�Ļ������ȡ�ϴ����ĵ���(CuSO45H2O)�����������ϵ�֪������Һ�е�����Һ������Զ�ʹCu2+��Fe2+��Fe3+�ֱ����ɳ�����pH
���� | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
��ʼ����pH | 6.0 | 7.5 | 1.4 |
������ȫpH | 13 | 14 | 3.7 |
ʵ�����������Լ��ɹ�ѡ��
A����ˮ B��H2O2 C������ D��NaOH E����ˮ F��Cu2(OH)2CO3
ʵ��С���������ʵ�鷽����
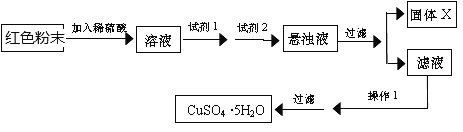
�Իش𣺢��Լ�1Ϊ____________���Լ�2Ϊ_____________������ĸ����
�ڹ���X�ijɷ�Ϊ____������1Ϊ ________________��
���𰸡� ��Һ��ΪѪ��ɫ ������ Fe2O3��Cu2O�Ļ���� Fe2O3+6H+=2Fe3++3H2O��Cu2O+2H+=Cu+Cu2++H2O��2 Fe3++Cu=2 Fe2++Cu2+ ![]() B F Cu2(OH)2CO3��Fe(OH)3 ����Ũ������ȴ�ᾧ
B F Cu2(OH)2CO3��Fe(OH)3 ����Ũ������ȴ�ᾧ
��������������������⿼�����ʵ�̽��ʵ������ʵ��Ʊ����漰Fe3+�ļ��飬ʵ�鷽�������ۣ������ļ��㣬ʵ�鷽������ơ�
��1��������1������Fe2O3������ϡ���ᷴӦ����Fe2��SO4��3��H2O����Һ����Fe3+������KSCN��Һ����Һ��ΪѪ��ɫ��
��2�����μ� KSCN �Լ�����Һ�����ɫ��˵����ϡ���ᷴӦ�����Һ�в���Fe3+��������֤��ԭ������һ������Fe2O3��ԭ���������Fe2O3��Cu2O�Ļ����Cu2O��ϡ���ᷴӦ���ɵ�Cu��Fe2O3��ϡ���ᷴӦ���ɵ�Fe3+��ԭ��Fe2+��������Ӧ��Cu2O+H2SO4=CuSO4+Cu+H2O��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��Cu+ Fe2��SO4��3=CuSO4+2FeSO4������������˵����������
��3���������ĩ��ȫ�ܽ�������ڣ��μ� KSCN �Լ�ʱ��Һ�����ɫ����֤������3������ɫ��ĩ��Fe2O3��Cu2O�Ļ������������������Ӧ���������ӷ���ʽΪ��Fe2O3+6H+=2Fe3++3H2O��Cu2O+2H+=Cu+Cu2++H2O��Cu+2Fe3+=Cu2++2Fe2+��
��4������������ϣ�����ʱ������Ӧ��2Cu2O+O2![]() 4CuO���������ӵ�����Ϊ����O2��������n��O2��=
4CuO���������ӵ�����Ϊ����O2��������n��O2��=![]() mol�����ݷ���ʽn��Cu2O��=
mol�����ݷ���ʽn��Cu2O��=![]() mol��m��Cu2O��=
mol��m��Cu2O��=![]() mol
mol![]() 144g/mol=9��b-a��g��Cu2O����������Ϊ
144g/mol=9��b-a��g��Cu2O����������Ϊ![]() 100%��
100%��
��5����ɫ��ĩ����ϡ���ᷢ����Ӧ��Cu2O+H2SO4=CuSO4+Cu+H2O��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��Cu+ Fe2��SO4��3=CuSO4+2FeSO4��������Һ�к�CuSO4��FeSO4��Fe2��SO4��3�����������ṩ��Cu2+��Fe2+��Fe3+��ʼ�����ͳ�����ȫ��pH��Ҫ��FeSO4��ȥ�����Ƚ�Fe2+������Fe3+���Լ�1Ϊ���������Լ�1��������ˮ������ˮ��������������Cl-�����������ᣬ����������������Ⱦ��Լ�1ѡ��H2O2��H2O2�Ļ�ԭ����ΪH2O�������������ʲ�����������Ⱦ��Լ�1ѡB����2�ǵ�����Һ��pHʹFe3+��ȫ��������ȥ��Ϊ�˲����������ʣ��Լ�2ѡ��Cu2��OH��2CO3����ѡ��NaOH�Ͱ�ˮ����NaOH��ˮ�������ʣ��Լ�2ѡF������pH�ķ�Χ��3.7~6.0֮�䣻��������Һ�����˵õ��Ĺ���XΪFe��OH��3��Cu2��OH��2CO3����ҺΪCuSO4��Һ��
�����������������Լ�1ΪB���Լ�2ΪF��
������X�ijɷ�ΪFe��OH��3��Cu2��OH��2CO3����CuSO4��Һ�л��CuSO4��5H2O�IJ���Ϊ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ��������1Ϊ����Ũ������ȴ�ᾧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ��4CO(g)+2NO2(g)=4CO2(g)+N2(g����H=-1200KJ/mol���¶Ȳ�ͬ(T2>T1������������ͬʱ������ͼ����ȷ����

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ����������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ���
A. SiO2![]() SiCl4
SiCl4![]() Si
Si
B. FeS2![]() SO2
SO2![]() H2SO4
H2SO4
C. N2![]() NH3
NH3![]() NH4Cl(aq)
NH4Cl(aq)
D. MgCO3![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ�������ữ�ĸ��������Һ���Թ��е��������Ҷ��ᱥ����Һ�����۲쵽�Թ�����Һ��ɫ���Ϻ�ɫ��Ϊ��ɫ���ɴ˿�֪���Ҷ������(����)
A. ������ B. ��ԭ�� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е�������������ʱ����Ӧ����(�¶ȡ���Ӧ������)�ı䣬�����������ı����( )
A. Fe ��HCl B. NaOH ��CO2 C. Na ��O2 D. AlCl3��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ũ�Ⱦ�Ϊ 0.1 molL-1�������Ϊ 100 mL ������һԪ�� HX��HY����Һ�����ֱ���� NaOH���壬lg[c(H+ )/c(OH�� )]����� NaOH�����ʵ����ı仯��ͼ��ʾ������˵����ȷ����
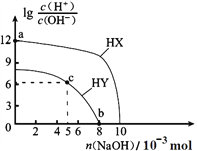
A. �����µ��볣����HX < HY![]()
B. a ����ˮ������� c(H+)=10-12 molL-1
C. c ����Һ�У�c(Y�� )��c(HY )![]()
D. b ��ʱ���ǡ����ȫ�к�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�ȥ���ʵķ�����ȷ����(����)
���� | ���� | �Լ� | ��Ҫ���� | |
A | NaHCO3���� | Na2CO3���� | / | ���� |
B | SiO2 | Al2O3 | ����������Һ | ���� |
C | Cl2 | HCl | ����ʳ��ˮ | ϴ�� |
D | CO2 | HCl | ����̼������Һ | ϴ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ϩ��������������ȥ��������ϩ�IJ��������ǣ� ��
A.����ʯ��ˮ��Ũ����
B.KMnO4������Һ��Ũ����
C.��ˮ��Ũ����
D.Ũ���ᡢKMnO4������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�������300 ����70 MPa���ɶ�����̼�������ϳ��Ҵ��ѳ�Ϊ��ʵ���䷴Ӧ�Ļ�ѧ����ʽΪ2CO2(g) �� 6H2(g)![]() CH3CH2OH(g) �� 3H2O(g)������������ȷ����
CH3CH2OH(g) �� 3H2O(g)������������ȷ����
A. ��v(CO2)��2v(CH3CH2OH)ʱ����Ӧһ���ﵽƽ��״̬
B. ��ƽ��������Ӧ�����ƶ�ʱ��ƽ�ⳣ��һ������
C. ����ѹǿ�������CO2��H2��ת����
D. ��ͬ�����£�2 mol��ԭ�������е���������1 mol����������е�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com