
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200KJ/mol,温度不同(T2>T1)其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】我国酸雨形成的主要原因是( )
A. 石油、天然气等燃烧产生大量二氧化碳
B. 大量燃烧含硫量高的煤产生二氧化硫
C. 大量使用含氟利昂的冰箱、空调等
D. 各种机动车排放的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、X是中学化学中常见的4种物质,其转化关系如图,其中甲和X不可能是

A. 甲为C2H5OH、X为O2 B. 甲为H2S、X为O2
C. 甲为HNO3、X为Fe D. 甲为AlCl 3溶液、X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.任何化学反应都会伴随着能量的变化
B.需要加热才能发生的反应一定是吸热反应
C.反应物的总能量大于生成物的总能量,则该反应为放热反应
D.断键吸收的总能最大于成键放出的总能量,则该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在3L密闭容器中进行的某一可逆反应,该反应中的X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。由图中数据分析:

①该反应的化学方程式:______________________。
②反应开始至3min末,Z的反应速率为_____________________。
③该反应是由_____________开始反应的。(填“正反应”、“逆反应”或“正、逆反应同时”)
(2)将SO2、O2在某密闭容器中混合,在450 ℃发生反应:2SO2(g)+O2(g) ![]() SO3(g)。
SO3(g)。
①增大压强,则正反应速率________(填:增大、减小或不变,下同),逆反应速率________。
②维持容器容积不变,加入0.1 mol SO2的一瞬间,正反应速率________,逆反应速率________;若加入的是0.1 mol He,则正、逆反应速率________。
③若维持容器压强不变,加入0.1 mol He后,容器的容积________,物质的浓度________,反应速率________。
(3)在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
①该反应的平衡常数表达式为___________;从表中分析:c1___________c2, c3___________c4(填“>”、“<”或“=”)。
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1
③若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示。下列有关说法正确的是


A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 如图所示装置可以比较Na2CO3和NaHCO3晶体热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 既能与盐酸反应,又能与NaOH溶液反应的是
①Si;②Al(OH)3;③NaHCO3;④Al2O3;⑤Na2CO3
A.全部 B.①②④ C.②④⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4, Cu2O在空气中加热生成CuO
【提出假设】
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
【设计探究实验】
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则预期实验现象是_________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?___________。
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设________成立,写出发生反应的所有离子方程式____________________。
【探究延伸】
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________________。
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO45H2O),经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:
A.氯水 B.H2O2 C.硝酸 D.NaOH E.氨水 F.Cu2(OH)2CO3
实验小组设计如下实验方案:
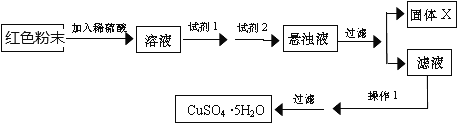
试回答:①试剂1为____________,试剂2为_____________(填字母)。
②固体X的成分为____,操作1为 ________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com