
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
【答案】 样品中无Fe3+ 硫酸亚铁易被空气氧化为硫酸铁 干燥管 dabfce ![]() 偏小 c、a 产生白色沉淀、品红溶液褪色 2FeSO4
偏小 c、a 产生白色沉淀、品红溶液褪色 2FeSO4![]() Fe2O3+SO2↑+SO3
Fe2O3+SO2↑+SO3
【解析】(1)样品溶于水滴加KSCN溶液,溶液颜色无明显变化,说明样品中无Fe3+;再向试管中通入空气,溶液逐渐变红,这说明有铁离子产生,即硫酸亚铁易被空气氧化为硫酸铁,铁离子遇KSCN溶液显红色;
(2)①根据仪器构造可知B是干燥管;
②由于装置中含有空气,空气能氧化硫酸亚铁,所以加热前需要排尽装置中空气,利用氮气排出空气,为了使生成的水蒸气完全排除,应该先熄灭酒精灯再冷却,然后关闭K1和K2,最后称量,即正确的排序是dabfce;
③样品的质量是(m2-m1)g,加热后剩余固体是硫酸亚铁,质量为(m3-m1)g,生成水的质量为(m2-m3)g,
FeSO4·xH2O![]() FeSO4 + xH2O
FeSO4 + xH2O
152 18x
(m3-m1)g (m2-m3)g
则: ![]() ,解得:x=
,解得:x=![]() ;
;
若实验时按a、d次序操作,在加热过程中硫酸亚铁被空气氧化为硫酸铁,导致m3增加,因此x偏小;
(3)①最终得到红棕色固体,说明有氧化铁生成,即分解过程发生了氧化还原反应,根据化合价变化可知一定有SO2生成,这说明硫酸亚铁分解生成氧化铁、SO2和三氧化硫。三氧化硫溶于水生成硫酸,硫酸和钡离子结合生成白色沉淀硫酸钡,由于硝酸钡在酸性溶液中有氧化性,能氧化SO2,所以应该用氯化钡,检验SO2用品红溶液,所以C、D的溶液依次为氯化钡溶液和品红溶液,实验现象是C中溶液变浑浊产生白色沉淀,D中品红溶液褪色,故答案为c、a;
②根据以上分析可知硫酸亚铁高温分解生成氧化铁、SO2和SO3,根据电子守恒和原子守恒得此反应的方程式为2FeSO4![]() Fe2O3+SO2↑+SO3。
Fe2O3+SO2↑+SO3。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a 、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近均有气泡产生;铜珠n的右侧有气泡产生。 |
下列对实验现象的解释或推测不合理的是( )
A. 根据实验一的原理,实验二中铜珠m左侧变厚
B. a、d处:2H2O+2e-=H2↑+2OH-
C. b处:2Cl--2e-=Cl2↑;Cl2 + H2O =HCl + HClO
D. c处发生了反应:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代陶瓷烧制工艺的珍品“唐三彩”中的蓝色,其釉料的着色剂是一种含钴矿物。钴在制取颜料和制备合金方面有着重要的应用,回答下列问题。
(1)基态Co2+的核外电子排布式为__________,基态Co原子中空间运动状态不同的电子数为___种。
(2)配合物[Co(NH3)5Br](NO3)2中存在的化学键类型有__________,配体NH3中配位原子的杂化轨道类型为__________,NO3-的空间构型是__________,第一电离能N__________(填“大于”或“小于”)O。
(3)CoO2具有如图所示的层状结构(小球表示Co,大球表示O)。下列用粗实线画出的结构单元不能描述其化学组成的是__________(填字时代号)。
A.  B.
B. 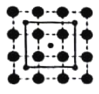 C.
C. 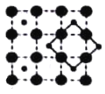 D.
D. 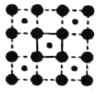
(4)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________ nm(结果保留三位小数,下同)。CoO也属于NaCl型结构,晶胞参数为a'=0.488 nm,则r(Co2+)为________ nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是

A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
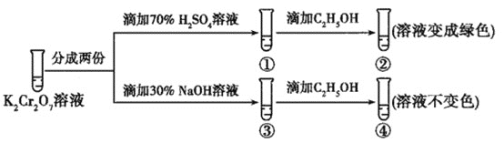
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组将装有铜与浓硫酸烧瓶加热一段时间后,取出烧瓶中固体,探究其成分。查资料可知,浓硫酸与铜反应可能生成CuS或Cu2S,它们都难溶于水,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,固体呈黑色。
(ii)取少量黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变为蓝色,产生无色气泡。取少量上层清液于试管,滴加氯化钡溶液,产生白色沉淀。
①根据实验(i)得到蓝色溶液可知,固体中含____________(填化学式)
②根据实验(ii)的现象_______(填“能”或“不能”)确定黑色固体是CuS还是Cu2S,理由是__________________________________________________________________________。
写出Cu2S与稀硝酸反应的化学方程式____________________________________________
③为了进一步探究黑色固体的成分,将实验(i)中黑色固体洗涤、烘干,再称取48.0g黑色固体进行如下实验,通入足量O2,使硬质玻璃管中黑色固体充分反应,观察到F瓶中品红溶液褪色。

实验序号 | 反应前黑色固体质量/g | 充分反应后黑色固体质量/g |
I | 48.0 | 48.0 |
Ⅱ | 48.0 | 44.0 |
Ⅲ | 48.0 | 40.0 |
根据上表实验数据推测:实验I中黑色固体的化学式为_____________________________;实验Ⅱ中黑色固体的成分及质量为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率=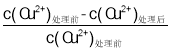 ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
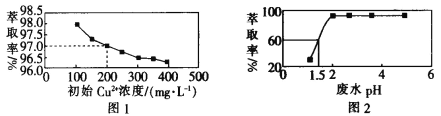
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据如表所示:
溶解度/(g/100g水)
0 | 20 | 40 | 60 | 80 | 100 | |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
溶度积常数
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为______,电池反应的离子方程式为____
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn_____g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和______,欲从中得到较纯的MnO2,最简便的方法是_____________,其原理是_______/span>。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com