Ⅰ.在一固定容积的密闭容器中进行着如下反应:CO
2(g) + H
2(g)
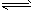
CO(g) + H
2O(g) 其平衡常数K和温度t的关系如下
(1)K的表达式为:______________;
(2)该反应的正反应为______________反应(“吸热”或“放热”);
(3)能判断该反应是否已经达到化学平衡状态的是:_______________
A.容器中压强不变
B.混合气体中CO浓度不变
C.v(H
2)正 = v(H
2O)逆
D.c(CO
2) = c(CO)
(4)在850℃时,可逆反应:CO
2(g) + H
2(g)

CO(g) + H
2O(g),在该容器内各物质的浓度变化如下
计算:3min-4min达到平衡时CO的平衡浓度c3,要求写出简单的计算过程(c3精确到小数点后面三位数)。________________________________
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应
回答下列问题:
(5)新工艺的总反应为:3CO(g)+3H
2(g)
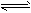
CH
3OCH
3(g)+CO
2(g) ΔH 该反应ΔH=______________。
(6)增大压强,CH
3OCH
3的产率____________(填“增大”、“减小”或“不变”)。
(7)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。新工艺中反应③的发生提高了CH
3OCH
3的产率,原因是_________________________。
(8)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,试验结果如下图CO转化率随温度变化的规律是_________________________________,原因是_________________________。

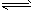 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下
 CO(g) + H2O(g),在该容器内各物质的浓度变化如下
CO(g) + H2O(g),在该容器内各物质的浓度变化如下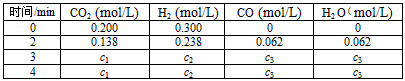

 CH3OCH3(g)+CO2(g) ΔH 该反应ΔH=______________。
CH3OCH3(g)+CO2(g) ΔH 该反应ΔH=______________。 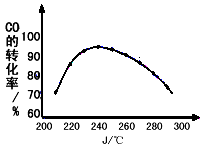
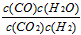


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 ,则n值____________________。
,则n值____________________。