
| A. | 足量的烧碱溶液与二氧化碳的反应:OH-+CO2═HCO3- | |
| B. | 盐酸溶液与硝酸银溶液反应:HCl+Ag+═AgCl↓+H+ | |
| C. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
分析 A.烧碱过量,反应生成碳酸钠和水;
B.氯化氢为强电解质,应拆成离子形式;
C.二氧化碳少量反应生成硅酸沉淀和碳酸钠;
D.不符合反应客观事实.
解答 解:A.足量的烧碱溶液与二氧化碳的反应,离子方程式:2OH-+CO2═H2O+CO32-,故A错误;
B.盐酸溶液与硝酸银溶液反应,离子方程式:Cl-+Ag+═AgCl↓,故B错误;
C.向Na2SiO3溶液中通入少量CO2,离子方程式:SiO32-+CO2+H2O═H2SiO3↓+CO32-,故C正确;
D.铜与稀硫酸不反应,故D错误;
故选:C.
点评 本题考查了离子方程式正误判断,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
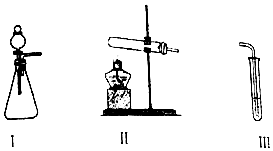
| 操作 | 现象 | |
| 甲 | 向I中加入必要的试剂,并向III中加入KI、淀粉溶液.连接I、III,打开活塞 | I中剧烈反应,产生无色气体并伴随大量白雾;III中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向II中加入必要的试剂,并向III中加入KI、淀粉溶液和稀硫酸.连接II、III,点燃酒精灯 | III中有气泡冒出,溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
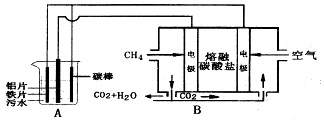
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
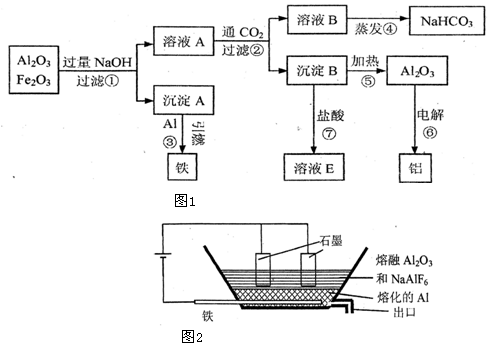
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
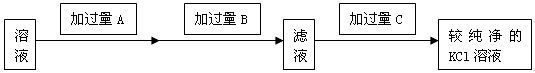
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 1:6:9 | C. | 1:3:4 | D. | 1:3:6 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.40g碳化硅晶体中含有的C—Si的数目为2NA
B.1L 1 mol·L-1 AlCl3溶液中含有的Al3+数目为NA
C.0.1mol熔融的NaHSO4中含有的阳离子为0.2 NA个
D.在标况下,11.2L HCHO中含有π键的数目为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com