
【题目】1980年,古迪的夫发明了钴酸锂材料,这种材料的结构可以使锂离子在其中快速移动。以LiCoO2作电极材料的锂离子电池在充、放电时的微观粒子变化如图所示,下列说法正确的是
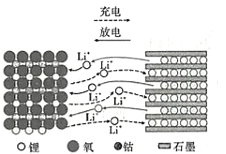
A.LiCoO2是电池的负极材料
B.充电时,LiCoO2电板的电势低于石墨电极
C.充电时,阳极发生的反应是LiCoO2+xe-=Li1-xCoO2+xLi+
D.放电时,当1mol电子转移,则石墨电极质量减少7g
科目:高中化学 来源: 题型:
【题目】对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 ΔH1 快速平衡
NO2+NO3 ΔH1 快速平衡
第二步 NO2+NO3→NO+NO2+O2 ΔH2 慢反应
第三步 NO+NO3→2NO2 ΔH3 快反应
下列说法正确的是( )
A.使用催化剂可以改变第一步中NO2平衡产量
B.第二步NO2和NO3的碰撞都是有效的
C.反应2N2O5(g)→4NO2(g)+O2(g)的ΔH=2ΔH1+ΔH2+ΔH3
D.第二步反应的活化能小于第三步反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种极易溶于水且几乎不与冷水反应的黄绿色气体(沸点11℃),实验室制备纯净ClO2溶液的装置如图所示:

已知下列反应:NaClO3+HCl→NaCl+ClO2+Cl2+H2O;NaClO2+HCl→NaCl+ClO2+H2O;NaClO2+Cl2→NaCl+ClO2(均未配平)。下列说法正确的是
A.a中通入的N2可用CO2或SO2代替B.b中NaClO2可用饱和食盐水代替
C.c中广口瓶最好放在冰水浴中冷却D.d中吸收尾气后只生成一种溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、硼的合金及其化合物用途非常广泛。回答下列问题:
(1)基态Cr原子核外电子的排布式是[Ar] ___;基态硼原子中占据最高能级的电子云轮廓图为____形。
(2)铬的配合物有氯化三乙二胺合铬![]() 和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
①配体en表示NH2CH2CH2NH2,其中碳原子的杂化方式是____。
②NH4+空间构型为____,与其键合方式相同且空间构型也相同的含硼阴离子是_____ 。
③C、N、O三种元素第一电离能由小到大的顺序为 ___;![]() 含有三个五元环,画出其结构:_______________。
含有三个五元环,画出其结构:_______________。
(3)硼酸[H3BO3或B(OH)3]为白色片状晶体,熔点为171℃。下列说法正确的是___填字母)。
A.硼酸分子中,∠OBO的键角为120° B.硼酸分子中存在σ键和π键
C.硼酸晶体中,片层内存在氢键 D.硼酸晶体中,片层间存在共价键
(4)2019年11月《EurekAlert》报道了铬基氮化物超导体,其晶胞结构如图所示:

由三种元素Pr(镨)、Cr、N构成的该化合物的化学式为 ___。
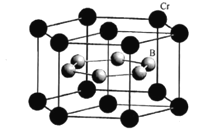
(5)CrB2的晶胞结构如图所示,六棱柱底边边长为acm,高为c cm,阿伏加德罗常数的值为NA,CrB2的密度为 ___gcm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国的稀土资源十分丰富,有开采价值的储量居世界第一。某实验小组拟利用含铝、硅、铁等杂质的氟碳钵矿(主要成分为CeFCO3)制备三氯化铈,设计如图所示流程:
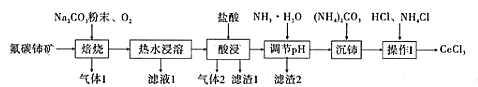
已知:①Ce2O3在加热条件下能被氧气氧化,生成难溶于水、具有强氧化性的CeO2。
②M(CeCl3)=246.5g/mol,在水溶液中Ce4+能被还原成Ce3+。
③0.1mol·L-1金属阳离子形成氢氧化物沉淀的pH如下:
金属阳离子 | Fe3+ | Ce3+ | Al3+ |
开始沉淀的pH | 1.5 | 7.6 | 3.4 |
沉淀完全的pH | 2.8 | 9.4 | 4.7 |
回答下列问题:
(1)氟碳铈矿中铈的化合价为______,滤渣1的化学式为__________。
(2)焙烧氟碳铈矿生成CeO3的化学方程式是____________。
(3)酸浸时产生气体2的离子反应方程式是_______。
(4)为将铝、铁以滤渣2除去,用NH3·H2O调节酸浸后溶液的pH最大不能超过______。
(5)将沉铈得到的Ce2(CO3)3·nH2O洗涤干净后继续进行操作I,简述如何证明Ce2(CO3)3·nH2O已经洗涤干净________。
(6)操作I是将得到的Ce2(CO3)3·nH2O加盐酸至沉淀完全溶解,先经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CeCl3·7H2O,再将该晶体与NH4Cl固体隔绝空气共热,得到无水CeCl3。其中,NH4Cl的作用是___________。
(7)产品纯度测定:准确称取CeCl3产品0.3750g于锥形瓶中,加入合适的氧化剂将Ce3+恰好完全氧化为Ce4+,再用0.1000mol/L的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复3次实验,标准液的消耗体积分别为12.48mL、12.50mL、12.52mL。求该样品的质量分数为_______(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定意义重大,氮肥的使用大面积提高了粮食产量。人工固氮最有效的方法是合成氦,一种工业合成氨的简易流程如图所示(净化、后期处理等流程未列出):

回答下列问题:
Ⅰ.步骤A制氢气的原理之一是CH4(g)+2H2O(g)CO2(g)+4H2(g) H=a kJ/mol
(1)已知:H2、CH4的燃烧热分别为285.8kJ/mol、890.31k/mol;H2O(g)H2O(l) H=-44kJ/mol则a=____kJ/mol。
(2)在密闭容器中,既能加快反应速率,又一定能提高平衡体系中H2体积分数的措施是_____(填序号)。
a.加入催化剂 b.升高温度 c.降低压强 d.增大c(H2O)
Ⅱ.步骤B完成了原料气准备后,通过步骤C合成氨,其原理为N2(g)+3H2(g)![]() 2NH3(g) H=-92.4kJ/mol。
2NH3(g) H=-92.4kJ/mol。
(3)若T℃下,向一个容积为2L的真空密闭容器中(有催化剂)通入lmol N2、3mol H2,1分钟后达到化学平衡状态,测得容器内的压强是开始时的0.8倍。则:
①下列叙述可说明该反应已经达到化学平衡状态的是______(填序号)。
a.3v(H2)正=2v(NH3)逆 b.混合气体的平均相对分子质量不再发生改变
c.混合气体的密度不再发生改变 d. 1个N≡N键断裂的同时有3个H—H键生成
②t分钟内v(H2)=_______。
③T℃下该反应的K=___________(列出计算式即可)。
④一定条件下,向体积相同的甲(含催化剂)、乙两个容器中分别充入等物质的量的N2和等物质的量的H2进行合成氨反应,均反应1小时、测得N2的转化率随温度变化如图所示,a、b、c三点中达到化学平衡状态的点有_________,乙装置中N2转化率随着温度的升高先升后降的原因可能是______。

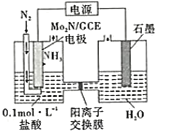
(4)我国科学家成功研制出一种高效电催化固氮催化剂Mo2N,其固氮原理如图所示,该装置中,阴极上的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯及其同系物是现代居室污染物的主要来源。回答下列问题:
(1)写出分子式为C6H6的一种含碳碳三键且无支链的链烃的结构简式:_________。
(2)已知1,3-环己二烯(![]() )脱去2 mo1H 变成苯放出热量。则苯比1,3-环己二烯_____________(填“稳定”或“不稳定”)。
)脱去2 mo1H 变成苯放出热量。则苯比1,3-环己二烯_____________(填“稳定”或“不稳定”)。
(3)苯的凯库勒式不能解释的事实是______(填字母)。
a.苯不能使溴水褪色
b.苯能与 H2发生加成反应
c.溴苯没有芳香族类同分异构体
d.邻二溴苯只有一种
(4)现代化学认为苯分子中碳碳之间的键是__________,故苯分子既能发生取代反应又能发生加成反应。
(5)甲苯是苯的同系物。甲苯_________(填“能”或“否”)使酸性高猛酸钾溶液褪色;甲苯与混合酸在加热条件下生成三硝基甲苯的反应方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.反应2HI(g)![]() H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
C.合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率
D.用HCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com