

| A. | 该过程是一种新的硫酸生产方法 | |
| B. | C2H5OSO3H具有酸性 | |
| C. | 该过程中①、②是加成反应 | |
| D. | 该过程中③、④可看做酯类的水解反应 |
分析 A、从整个反应来看硫酸充当催化剂,并没有新的硫酸生成;
B、C2H5OSO3H能电离出一个H离子,具有一元酸的性质;
C、根据乙烯的加成反应;
D、根据酯类水解反应的定义分析.
解答 解:A、从整个反应来看硫酸充当催化剂,并没有新的硫酸生成,不是一种新的硫酸生产方法,故A错误;
B、C2H5OSO3H能电离出一个H离子,具有酸性,故B正确;
C、过程中①、②是乙烯的加成反应,故C正确;
D、过程中③、④中的均是酯类分开得到醇和酸,可以看作是酯类的水解反应,故D正确;
故选A.
点评 本题主要考查了乙烯的性质、酯化反应的定义以及水解反应的定义,难度不大,根据题目信息结合所学知识即可完成.


科目:高中化学 来源: 题型:填空题
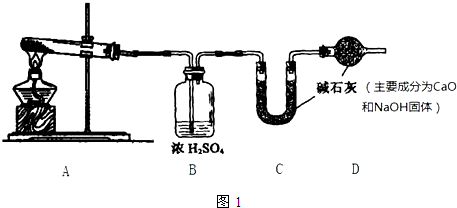
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
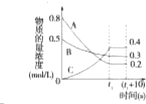 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则下列叙述正确的是( )
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则下列叙述正确的是( )| A. | 该反应的化学方程式为3A+B?2C | |
| B. | 在t1~(t110)s时,v(A)=v(B)=0 | |
| C. | t1 s时反应物A转化率为60% | |
| D. | 0~t1 s内A的反应速率为v(A)=$\frac{0.2}{{t}_{1}}$mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.请回答下列问题:
如图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
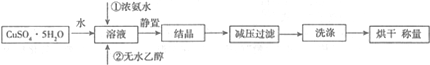

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CO2+Ca(OH)2═CaCO3↓+H2O | ||
| C. | 2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$ 2H2O+O2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸密闭存放于玻璃瓶中 | |
| B. | 硅主要以氧化物和硅酸盐形式存在于自然界中 | |
| C. | 铝是地壳中含量最多的金属元素 | |
| D. | 钢是用量最大、用途最广泛的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 4种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com