
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CO2+Ca(OH)2═CaCO3↓+H2O | ||
| C. | 2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$ 2H2O+O2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
| 元素 | 元素性质或结构 |
| A | 最外层电子数是其内层电子数的2倍 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
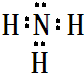 ,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式
,属于共价化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式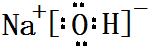 ,所含化学键类型:离子键、共价键.
,所含化学键类型:离子键、共价键.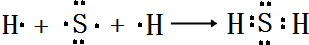 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
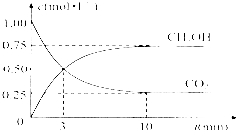 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 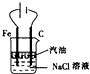 用如图装置制取Fe(OH)2沉淀 | |
| B. | 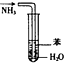 用如图装置吸收NH3,并防止倒吸 | |
| C. | 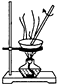 用如图装置蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 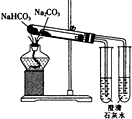 用如图装置比较Na2CO2与NaHCO3的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该过程是一种新的硫酸生产方法 | |
| B. | C2H5OSO3H具有酸性 | |
| C. | 该过程中①、②是加成反应 | |
| D. | 该过程中③、④可看做酯类的水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Fe加入CuSO4溶液:2Fe+3Cu2+═2Fe3++3Cu | |
| C. | AlCl3溶液中加入氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 通入澄清石灰水中 | B. | Na2CO3溶液和HCl溶液反应 | ||
| C. | AlCl3溶液的NaOH 溶液反应 | D. | 铁丝在氯气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种原子的电子层上全部都是s电子 | |
| B. | 原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子 | |
| C. | 最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子 | |
| D. | 3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种吸收过程中,Br2只作氧化剂 | |
| B. | 两种吸收过程都发生了氧化还原反应 | |
| C. | 用纯碱溶液作吸收剂时,纯碱作还原剂 | |
| D. | 用纯碱溶液作吸收剂只发生了复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com