
【题目】下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A. 凡是中心原子采取sp2杂化的分子,其分子构型都是平面三角形
B. 对于主族元素,中心原子的杂化轨道数等于价层电子对数
C. 杂化轨道可用于形成![]() 键、π键或用于容纳未参与成键的弧电子对
键、π键或用于容纳未参与成键的弧电子对
D. Sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp3杂化轨道
科目:高中化学 来源: 题型:
【题目】硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。
(1)制备硝酸铁
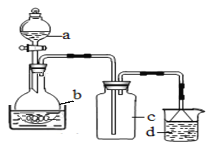
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:_______。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、_________、___________,用浓硝酸洗涤、干燥。
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是_________。
②用5mL __________溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:
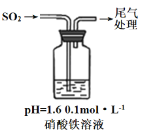
i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:_________。
⑤步骤ii后期反应的离子方程式是__________。
(3)由以上探究硝酸铁的性质实验得出的结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求书写
![]() 系统命名是________________________________
系统命名是________________________________
2—甲基—1,3-丁二烯的结构简式 __________________________________
(2)下列各对物质中属于同系物的是___________________,属于同分异构体的是____________属于同位素的是__________,属于同素异形体的是___________
A ![]() C与
C与![]() C B O2与O3
C B O2与O3
C  D
D 
E  与
与
(3)下列属于苯的同系物的是____________________(填字母)。
A  B
B ![]() C
C ![]() D
D 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列有机化合物,完成填空。
①CH4 ② C2H4 ③C2H2 ④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)①~⑧中,属于苯的同系物的是____ (填序号,下同)
(2)①分子的空间构型为_____,②中碳原子的杂化方式为_____。
(3)相同质量的①②③中,在相同状况下体积最小的是___,完全燃烧时消耗O2最多的是___。
(4)以⑧为原料制备TNT的化学方程式为______。
(5)④的系统命名为:____。
(6)若将CH4、O2和氢氧化钠溶液组成燃料电池,则电池的负极反应式为___。
(7)写出⑤的含有苯环的所有同分异构体______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制氨气的化学方程式为_________________________。
(2)0.1 mol/LNH4Cl溶液中离子浓度由大到小的顺序为____________________。
(3)已知0.5mol的液态甲醇(CH3OH)在空气中完全燃烧生成CO2气体和液态水时放出350kJ的热量,则表示甲醇燃烧热的热化学方程式为______________________。
(4)已知①C(s)+O2(g)= CO2(g) ΔH1=-393 kJ/mol
②2CO(g)+O2(g)= 2CO2(g) ΔH2=-566 kJ/mol
③TiO2(s)+2Cl2(g)= TiCl4(s)+O2(g) ΔH3=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)= TiCl4(s)+2CO(g)的 ΔH =__________________。
(5)在25℃下,向浓度均为0.1 mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀_____(填化学式)(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)。
(6)常温下,0.lmol/LNaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-)(填“>”、“=”或“<”)。
(7)在25℃下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显_________性(填“酸”“碱”或“中”),a _________0.01 mol/L(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中给出了四个实验装置和对应的部分实验现象,其中a、b、c、d为金属电极,由此可判断四种金属的活动性顺序是( )
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气泡产生 c极无变化 | d极溶解 c极有气泡产生 | 电流计指示在导线中 电流从a极流向d极 |
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式正确的是
A.热化学反应方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ·mol-1
B.用碳电极电解CuSO4溶液离子反应方程式:2Cu2++2H2O![]() 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
C.用电子式表示H2O中化学键形成过程:H2+O→H:O:H
D.过量的CO2通入NaAlO2溶液的化学方程式:2NaAlO2+CO2+3H2O=Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,其结构简式如图所示。下列有关叙述中不正确的是( )
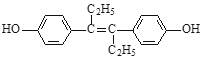
A. 己烯雌酚的分子式为C18H20O2
B. 己烯雌酚分子中一定有16个碳原子共平面
C. 己烯雌酚为芳香族化合物
D. 己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)回答下列问题:
①处于基态的Ca和Fe原子,下列参数前者小于后者的是_________;
a. 最外层电子数 b. 未成对电子数 c. 第一电离能 d. 原子半径
②有文献表明,迄今为止(至2016年)除氦外,所有其他稀有气体元素都能形成化合物。试简要说明未能制得氦的化合物的理由 _______________________。
(2)H和N可以形成多种化合物。
①已知联氨(N2H4)的物理性质与水接近,其原因是_____________________;
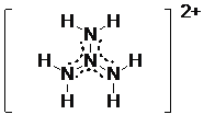
②计算表明: N4H62+ 的一种结构如图所示,氢原子只有一种化学环境,氮原子有两种环境,其中的大 π键可表示为_________________。
(3)晶体X只含钠、镁、铅三种元素。在不同的温度和压力下,晶体X呈现不同的晶相。
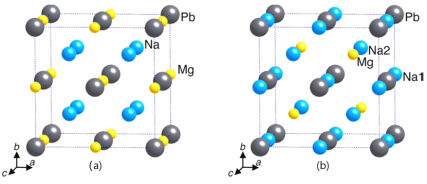
①γ-X 是立方晶系的晶体。铅为立方最密堆积,其余两种原子有选择的填充铅原子构成的四面体空隙和八面体空隙。在不同的条件下,γ-X 也呈现不同的结构,其晶胞如图所示。X的化学式为_____________;在(b)型晶胞中,边长为a pm,距离Pb最短的Na有_______个,长度为_______pm(用a表示);Na填充了晶胞中铅原子构成四面体空隙的百分比为________和八面体空隙的百分比为________。已知(a)型晶胞的边长为770 pm,则该型晶体的密度为_________g·cm-3。(只列出计算式)
②α-X是一种六方晶系的晶体,而在α-X中,镁和铅按 1:1 的比例形成类似于石墨的层状结构,钠填在层间。试画出一层α-X 的结构__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com