
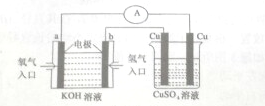
 氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:
氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:| 3.2g |
| 64g/mol |
| 0.1mol |
| 4 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
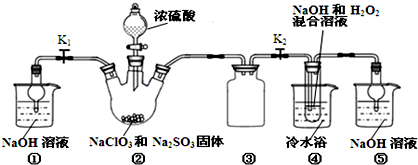
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液中加入过量氢氧化钠Ca2-+2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe2++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O═AlO2-+2NH4++2H2O |
| D、Na2S溶液呈碱性:S2-+H2O=HS-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥⑦ | B、②③⑤ |
| C、①③④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
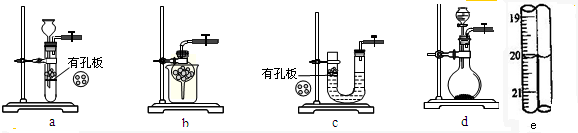
| 编号 | 1 | 2 | 3 |
| 消耗KI3溶液的体积/mL | 19.98 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 丁 |
| 丁 |
| 甲 |
| A、若甲为C2H5OH,则丙可能为CH3COOH |
| B、若涉及反应均为氧化还原反应,则甲可能为Cl2 |
| C、若涉及反应均为氧化还原反应,则丁可能为O2 |
| D、若甲为AlCl3溶液,则丁可能是NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
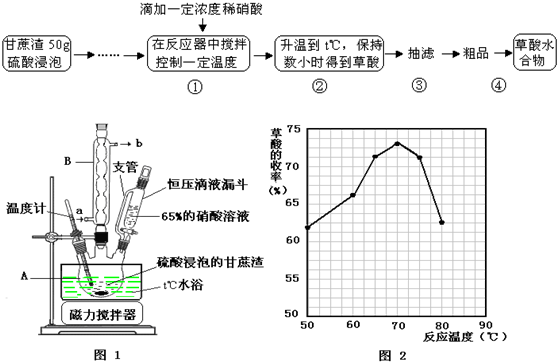
查看答案和解析>>
科目:高中化学 来源: 题型:
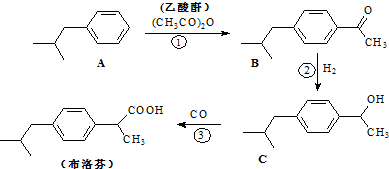

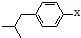 结构的酯类中共有6种(即X有不同的结构),请写出其中的二种
结构的酯类中共有6种(即X有不同的结构),请写出其中的二种查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com