
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
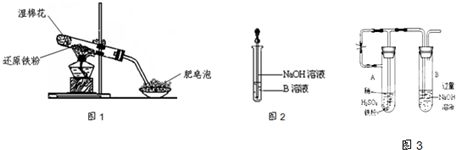
 在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.| 实验编号 | 实验操作 | 实验现象 |
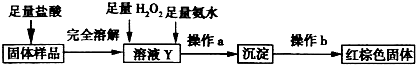
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中评价合理的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| FeO | 2- 4 |
| O | - 4 |
| O | - 4 |
| O | 2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com