
| A�� | �÷�Ӧ��NH4NO3ֻ�������� | |
| B�� | ÿ��ԭ1mol NO3-��������1mol Zn��1mol NH4+ | |
| C�� | ���ɵ����к���ZnO��NH4NO3 | |
| D�� | ���ɵİ�����N2����ˮ�γɵ�СҺ�� |
���� NH4NO3+Zn=ZnO+N2��+2H2O�У�ZnԪ�صĻ��ϼ����ߣ�NԪ�صĻ��ϼ���+5�۽���Ϊ0��NԪ�صĻ��ϼ���-3������Ϊ0���Դ������
��� �⣺A��NH4NO3��NԪ�صĻ��ϼ�����Ҳ���ͣ������������Ҳ����ԭ������A����
B���ɷ�Ӧ��֪���ɵ����غ��֪����NԪ�صĻ��ϼ����߿�֪��ת��1mol����5-0��=5mol���ӣ�ÿ��ԭ1mol NO3-��������1mol Zn��1mol NH4+����B��ȷ��
C���÷�Ӧ�������еĹ���ΪZnO�����ɵ����к���ZnO����C����
D�����ɰ���������йأ���СҺ���أ���D����
��ѡB��
���� ���⿼��������ԭ��Ӧ��Ϊ��Ƶ���㣬���շ�Ӧ��Ԫ�صĻ��ϼ۱仯��ת������Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��������������йأ���Ŀ�ѶȲ���


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼�����ϡ���ᷴӦ��CO32-+2H+�TCO2��+H2O | |
| B�� | ͭ����������Һ��Ӧ��Cu+2Ag+�T2Ag+Cu2+ | |
| C�� | ������ϡ�����У�2Fe+6H+�T2Fe3++3H2�� | |
| D�� | ����������Һ�еμ�ϡ���Ba2++SO42-�TBaSO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ۢܢ� | C�� | �٢ۢ� | D�� | �ڢۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��E�ĵ���ʽ
��E�ĵ���ʽ ��y�ĽṹʽH-Cl��
��y�ĽṹʽH-Cl�� ����Ӧ�ڵĻ�ѧ����ʽΪ3Fe+4H2O��g��$\frac{\underline{\;����\;}}{\;}$Fe3O4+4H2��Ӧ�ݵ����ӷ���ʽΪ2Fe3++Fe=3Fe2+
����Ӧ�ڵĻ�ѧ����ʽΪ3Fe+4H2O��g��$\frac{\underline{\;����\;}}{\;}$Fe3O4+4H2��Ӧ�ݵ����ӷ���ʽΪ2Fe3++Fe=3Fe2+�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2A������ | |
| B�� | ϡ��0.1mol/L H2A��Һ�������ƽ�������ƶ�������c��H+������ | |
| C�� | ��0.1mol/L��H2A��Һ�У�c��H+��=0.12mol/L | |
| D�� | ��0.1mol/L��NaHA��Һ��c��H+��=0.02mol/L����0.1mol/L��H2A��Һ��c��H+����0.12mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2CO3��Һ�����ʯ��ˮ�ķ�Ӧ | |
| B�� | ������ͭ��ϡ����ķ�Ӧ | |
| C�� | п���Ȼ�ͭ��Һ�ķ�Ӧ | |
| D�� | ������̼����ʯ����������̼��Ƶķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
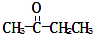 �������ᣨCH3CH2COOH���Ͷ����ᣨHOOCCH2CH2COOH�������Ʋ�����Ĺ���ʽ��
�������ᣨCH3CH2COOH���Ͷ����ᣨHOOCCH2CH2COOH�������Ʋ�����Ĺ���ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 25% | B�� | 50% | C�� | 75% | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Zn��s��+CuSO4��aq���TZnSO4��aq��+Cu��s����H=-216 kJ•mol-1����Ӧ������������������������ | |
| B�� | ��һ�������£�A�TB��H��0��˵��A���ʱ�B�����ȶ� | |
| C�� | 101 kPaʱ��2H2��g��+O2��g���T2H2O��l����H=-571.6 kJ•mol-1����H2��ȼ����Ϊ571.6 kJ•mol-1 | |
| D�� | H+ ��aq��+OH- ��aq���TH2O��l����H=-57.3 kJ•mol-1����1 mol NaOH����Һ�뺬0.5 mol H2SO4��Ũ�����Ϻ�ų�57.3 kJ������ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com