
 为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答下列问题:
为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答下列问题:分析 (1)从实验室制取氯气的原理:二氧化锰和浓盐酸加热反应生成氯气、氯化锰和水;
(2)从除杂质的角度:氯气中的氯化氢可以用饱和食盐水来除去;
(3)从置换反应判断元素非金属性强弱,氧化性强的单质可以置换氧化性弱的单质性;
(4)从判断元素非金属性强弱的方法:最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱;
(5)从原子结构的特点:氯原子的半径小于S原子半径,半径小,得电子能力强,据此回答;
解答 解:(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2,
故答案为:浓盐酸;MnO2;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为: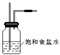 ,
,
故答案为: ,除去Cl2中的HCl气体;
,除去Cl2中的HCl气体;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为Na2S+Cl2=2NaCl+S↓,离子方程式为S2-+Cl2=2Cl-+S↓,
故答案为:A;有淡黄色沉淀生成;
(4)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HClO4的酸性比H2SO4的酸性强;氯气的氧化性强于单质S的氧化性,或是S2-比Cl-易被氧化;还可以根据单质将变价金属氧化到的价态高低来确定单质的氧化性,进而确定元素得非金属性强弱,故答案为:B;
(5)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强;
点评 本题考查了实验装置的分析判断和氯气制备和性质的分析应用,应从实验装置着眼,从比较Cl和S的非金属性强弱着手,从整体的角度把握题目需要解答的问题,要通过本题建立解答本类题的正确思维过程,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 强酸可以制弱酸 | 氢硫酸(H2S)无法制取硫酸 |
| B | 反应物浓度越大,反应速度越快 | 常温下,相同的铝片分别加入到浓、稀硫酸中,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随着相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解 度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴定KI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 三氧化二铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 铝与氢氧化钠溶液反应:2AI+2OH-═2 AIO2-+H2↑ | |
| D. | 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜与硝酸银溶液反应:Cu+2Ag+═2Ag+Cu2+ | |
| C. | 铁溶于稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氢氧化钡溶液中滴加稀硫酸:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com