

 =7.2 g
=7.2 g

科目:高中化学 来源:不详 题型:单选题

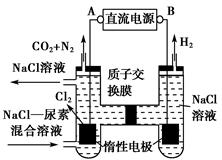
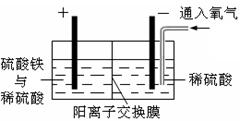
| A.a为直流电源的负极 |
| B.阴极的电极反应式为:2HSO3-+2H++e-=S2O42-+2H2O |
| C.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
| D.电解时,H+由阴极室通过阳离子交换膜到阳极室 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
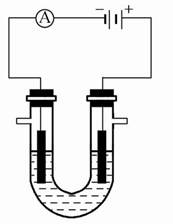
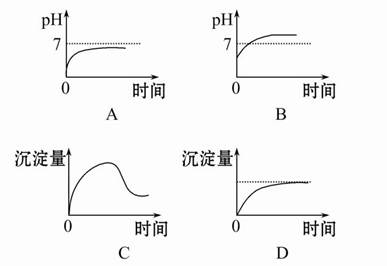
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
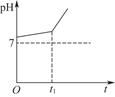
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba(OH)2 | B.HCl | C.Na2SO4 | D.AgNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
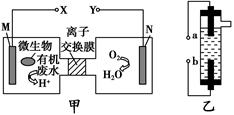
| A.装置乙的a极要与装置甲的X极连接 |
| B.装置乙中b极的电极反应式为2Cl--2e-=Cl2↑ |
| C.若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| D.N电极发生还原反应,当N电极消耗5.6 L(标准状况下)气体时,则有2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+ | B.Br- | C.Cu2+ | D.Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com