
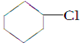
 (一氯环己烷)$→_{△②}^{NaOH、乙醇}$
(一氯环己烷)$→_{△②}^{NaOH、乙醇}$ $→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$
$→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$
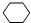 ,名称是环己烷.
,名称是环己烷.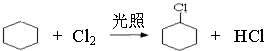 、
、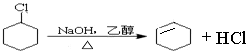 .
. 分析 由合成路线可知,反应①为光照条件下的取代反应,所以A为 ,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为
,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为 ,反应④为卤代烃的消去反应生成1,3-环己二烯,据此解答.
,反应④为卤代烃的消去反应生成1,3-环己二烯,据此解答.
解答 解:由合成路线可知,反应①为光照条件下的取代反应,所以A为 ,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为
,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为 ,反应④为卤代烃的消去反应生成1,3-环己二烯,(1)A为
,反应④为卤代烃的消去反应生成1,3-环己二烯,(1)A为 ,名称是:环己烷,故答案为:环己烷;
,名称是:环己烷,故答案为:环己烷;
(2)反应①为取代反应,反应②为消去反应,故答案为:取代反应;消去反应;
(3)反应①是环己烷和氯气光照得到 ,化学反应方程式是
,化学反应方程式是 ,
,
反应②是 在氢氧化钠乙醇溶液、加热条件下发生消去反应生成
在氢氧化钠乙醇溶液、加热条件下发生消去反应生成 ,反应②的方程式为
,反应②的方程式为 ,
,
故答案为: 、
、 .
.
点评 本题考查有机物的合成、有机反应类型、有机反应方程式书写,注意根据反应条件与有机物结构解答,注意卤代烃的水解、消去反应的条件,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2→CH3-CH3 | B. | CH2=CH2+3O2→2CO2+2H2O | ||
| C. | CH2=CH2+Br2→CH2Br-CH2Br | D. | CH2=CH2+H2O$\frac{\underline{\;催化剂\;}}{\;}$CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com