
 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算焓变=反应物总键能-生成物的总键能,以此计算反应热并判断吸热还是放热;
(2)依据热化学方程式书写热化学方程式,标注物质聚集状态和对应反应的焓变;甲烷燃料电池,燃料做电池的负极发生氧化反应;
(3)图中Ⅰ:铁和碳接触,腐蚀吸氧腐蚀,Ⅱ:铁和锌接触形成原电池反应,锌比铁活泼,铁被保护,Ⅲ:为化学腐蚀,速率比电化学腐蚀慢,以此解答该题.
解答 解:(1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算焓变=反应物总键能-生成物的总键能,在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N≡N键共吸收的能量为:3×436.4kJ+941.3kJ=2250.5kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×390.5kJ=2343kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2343kJ-2250.5kJ=92.5kJ,所以生成1mol NH3放出热量为46.25kJ;
故答案为:吸热; 放热;放出;46.25kJ;
(2)已知标准状况下11.2L甲烷物质的量为0.5mol,完全燃烧生成液态水时放出445kJ的热量,所以1mol甲烷烷醛燃烧生成二氧化碳和液态水放热890.0kJ,
甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol;甲烷燃料电池,燃料做电池的负极发生氧化反应,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol;负;
(3)图中Ⅰ:铁和碳接触,腐蚀吸氧腐蚀,Ⅱ:铁和锌接触形成原电池反应,锌比铁活泼,铁被保护,Ⅲ:为化学腐蚀,速率比电化学腐蚀慢,则铁被腐蚀的速率由快到慢的顺序是①③②,
故答案为:Ⅰ>Ⅲ>Ⅱ.
点评 本题考查热化学方程式的书写和反应热的计算,注意把握从键能的角度计算反应热的方法,金属的腐蚀与防护,题目难度不大,注意把握金属腐蚀的原理,学习中注意积累.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:推断题
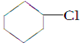 (一氯环己烷)$→_{△②}^{NaOH、乙醇}$
(一氯环己烷)$→_{△②}^{NaOH、乙醇}$ $→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$
$→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$
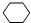 ,名称是环己烷.
,名称是环己烷.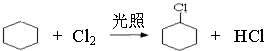 、
、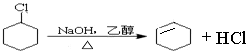 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
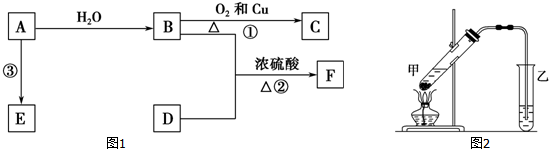
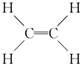 ,B的官能团名称为羟基.
,B的官能团名称为羟基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 邻二甲苯只有一种结构可以证明苯分子中无单双健的交替结构 | |
| C. | CH2Cl2无同分异构体可以证明CH4是正四面体的结构 | |
| D. | 乙烯、乙炔是平面型分子,可知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子 | |
| B. | NH3和CH4的空间构型相似 | |
| C. | BF3与 都是平面型分子 都是平面型分子 | |
| D. | CO2和H2O都是直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )
白藜芦醇的结构简式如图.它广泛存在于食物(如桑椹、花生,尤其是葡萄)中,可能具有抗癌性.下列有关白藜芦醇的说法正确的是( )| A. | 该有机物属于醇类 | |
| B. | 1mol该有机物与H2加成时最多消耗1mol H2 | |
| C. | 1mol该有机物与Br2反应时最多消耗6mol Br2 | |
| D. | 1mol该有机物最多消耗3mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com