
国产航母001A等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为:Zn+2CuSO4+2NaOH===Cu2O+ZnSO4+Na2SO4+H2O。该反应的下列说法正确的是( )

A. Zn得到电子
B. CuSO4被氧化
C. NaOH是还原剂
D. CuSO4是氧化剂
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:选择题
下列反应在一定条件下可以实现的是( )
①酸性氧化物与碱反应 ②有单质参加的非氧化还原反应
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月份模拟演练理综化学试卷(解析版) 题型:选择题
常温下,0.1000mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.1000mol·L-1的两种一元酸HX、HY溶液,滴定曲线如图所示。下列说法正确的是

A. HX是强酸,HY是弱酸
B. V[NaOH(aq)]=10.00mL时,
C. V[NaOH(aq)]=20.00mL时,所得的两种溶液的pH均等于7
D. V[NaOH(aq)]=20.00mL时,所得的两种溶液的导电性,HX的比HY的强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:简答题
KIO3是一种无色易溶于水的晶体,医药上可作防治地方甲状腺肿的药剂,目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:

(1) 检验“含碘废水”中含有的单质I2,常用的试剂是________。
(2) 进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加________盐溶液来检验其是否已洗涤干净。
(3) “滤渣2”的成分为____________(填化学式)。
(4) “制KI”时,发生反应的化学方程式为____________。
(5) 江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33 mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000 g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00 mL 6.000×10-4 mol·L-1 Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O; I2+2S2O ===2I-+S4O
===2I-+S4O 。
。
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程)。
_______
②该食盐试样是否符合江苏食用加碘盐新标准并说明判断依据。
_______
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
用蘸有浓氨水的棉棒检漏输氯管道的原理为:3Cl2+8NH3=N2+6NH4Cl。该反应的下列说法正确的是( )
A. 35.5 g氯气所含的分子数为6.02×1023
B. 常温常压下,22.4 L氨气所含原子总数为4×6.02×1023
C. 反应每生成1 mol N2转移电子数约为6×6.02× 1023
D. 1 mol·L-1 NH4Cl溶液中,含有Cl-数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
下列过程中吸收热量的是( )
A. 焦炭制水煤气 B. 浓硫酸的稀释
C. 酸碱中和反应 D. 镁条溶于盐酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
我国首飞的长征七号运载火箭采用液氧和煤油作为推进剂。煤油属于( )

A. 纯净物 B. 混合物 C. 氧化物 D. 单质
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳、信阳等六市高三第一次联考理综化学试卷(解析版) 题型:简答题
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内按照催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g)+2CO(g)=N2(g)+2CO2(g)) △H=_______kJ·mol-1
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
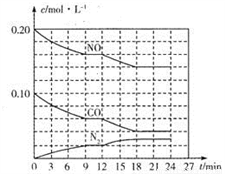
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-2的
HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省常州市高三第一次模拟考试化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列有关说法错误的是
A. 从海水中可提取镁,电解熔融氯化镁可制得金属镁
B. 应用高纯度单质硅制成光导纤维,提高信息传输速度
C. 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生
D. 开发二氧化碳制成的全降解塑料,缓解日益严重的“白色污染”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com