
��12�֣���2 L�ܱ������м���1 mol N2��3 mol H2��������Ӧ��N2��3H2 2NH3
2NH3
��1���÷�Ӧ�Ƿ����ڵ��Ĺ̶��� ����ǡ���
��2����ַ�Ӧ�� ����ܡ����ܡ����õ�2 mol NH3��Ϊʲô��
��3���������жϷ�Ӧ�ﵽƽ��״̬����
A��N2��H2��NH3��Ũ�Ȳ��ٷ����仯 B��N2��H2��NH3�ķ��������
C����λʱ��������a mol N2 ��ͬʱ����3a mol H2 D�������е�ѹǿ���ٷ����仯
��4������5���ʣ�µ�N2Ϊ0. 5 mol������H2Ũ�ȱ仯����ʾ�ķ�Ӧ�����Ƕ��٣�
5��ĩNH3Ũ���Ƕ��٣�
��1���ǣ� ��2�����ܣ���Ϊ�÷�Ӧ�ǿ��淴Ӧ����Ӧ�ﲻ����ȫת��Ϊ������
��3��AD ��4��0. 15 mol������1������1��0. 5 mol������1
����������1������̬�ĵ�ֱ��ת��Ϊ����̬�ĵ��Ĺ����ǵ����̶������Ը÷�Ӧ���ڵ��Ĺ̶���
��2����������1�����淴Ӧ������1 mol N2��3 mol H2������Ӧ������������2mol������
��3����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0�����������ʵ�Ũ�Ȼ��������ٷ����仯��״̬���ǻ�ѧƽ��״̬������A��ȷ��ƽ��ʱŨ�Ȳ��ٷ����仯��������֮���Ũ�Ȳ�һ����Ȼ�����ij�ֹ�ϵ�����B����ȷ��ѡ��C�з�Ӧ���ʵķ�������ͬ�ģ����Բ���˵�������ڷ�Ӧǰ������DZ仯�ģ�����ѹǿҲ�DZ仯�ġ���˵�ѹǿ���ٷ����仯ʱ������˵����Ӧ�ﵽ��ƽ��״̬��
��4��
N2��3H2 2NH3
2NH3
��ʼ����mol�� 1 3 0
ת������mol�� 0.5 1.5 1.0
ƽ������mol0 0.5 1.5 1.0
������H2Ũ�ȱ仯����ʾ�ķ�Ӧ������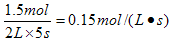
��ʱ������Ũ����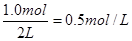


 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�������д�����2011�������ģ���ۻ�ѧ���� ���ͣ�058
������Ԫ��A��B��C��D��E��F��G�������������������࣬Aԭ����Ԫ���е����������ٵģ�B�������������Ǵ����������Ķ�����C����������������Ӳ�����������G��Cͬ������Ԫ�غ����������֮����D��E��Ԫ�غ����������֮����ȣ�F������������Ǵ����������Ķ���֮һ��
(1)��д��Ԫ��F�����ڱ��е�λ��________��
(2)����Ԫ��ABC��ɵ�18�������ʣ��Ǽپ��г������ж�����֮һ�������ʽΪ________��
(3)����֪��������ӦG(s)��C2(g) GC2(g)����H1����296 KJ��mol��1��2GC3(g)
GC2(g)����H1����296 KJ��mol��1��2GC3(g)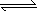 2GC2(g)��C2(g)����H2����198 KJ��mol��1
2GC2(g)��C2(g)����H2����198 KJ��mol��1
��2G(s)��3C2(g)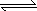 2GC3(g)����H3��________��
2GC3(g)����H3��________��
(4)�����ڿ��淴Ӧ��2GC2(g)��C2(g) 2GC3(g)����H��a KJ��mol��1ͼ���������߷ֱ��ʾ�¶�ΪT1��T2ʱ��ϵ��GC3�İٷֺ�����ʱ��Ĺ�ϵ��
2GC3(g)����H��a KJ��mol��1ͼ���������߷ֱ��ʾ�¶�ΪT1��T2ʱ��ϵ��GC3�İٷֺ�����ʱ��Ĺ�ϵ��
GC3��
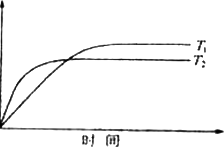
T1ʱƽ�ⳣ��K1��T2ʱƽ�ⳣ��K2����K1________K2(����������)��
T2ʱ��2 L�ܱ������г���4 moL��GC2��3 moL��C2����һ�������´ﵽƽ��ʱGC2��ת����Ϊ90��������ʱ��ƽ�ⳣ����ֵ��________��
(5)��D2FC3��Һ��E2(GC4)3��Һ��ϲ�������������DCA��Һ���������ʣ�д������Һ��������������ӷ�Ӧ����ʽ________��
(6)��Ba(AGC3)2��Һ�еμ�����A2C2����23.3�˰�ɫ����ʱ����Ӧ�е���ת���������ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)B��ƽ��Ũ��Ϊ____________________��
(2)A��ת����Ϊ______________________��
(3)����D�ķ�Ӧ����Ϊ____________________��
(4)�����С��Ӧ�����������ʹѹǿ����ƽ����ϵ��C�����ʵ�����Ũ��__________��C����������__________�������������ƽ���ܶ�____________________��ƽ����Է�������____________________��(���������С�����䡱)
(5)���������Ӧ����ͬ�����´��淴Ӧ��ʼ���У���ʼ��C��D��4/3 mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ����ȣ���Ӧ����__________����__________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ͼ1-2-9
(1)�ﵽƽ��ʱ��I2(g)�����ʵ���Ũ��Ϊ___________mol��L-1��
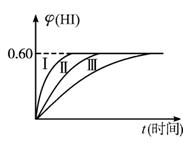
(2)���ı䷴Ӧ�������ڼ������¦�(HI)�ı仯��ͼ������(��)��ʾ�����������¦�(HI)�ı仯��ͼ������(��)��ʾ���������������___________��������������___________ (�����������������)��
�ٺ��������£������¶�
�ں��������½����¶�
�ۺ��������£���С��Ӧ���������
�ܺ��������£�����Ӧ���������
�ݺ��¡����������£������ʵ�����
(3)�������¶Ȳ��䣬����һ��ͬ��2 L�ܱ������м�a mol I2(g),b mol H2��c mol HI(a,b,c������0)��������Ӧ�ﵽƽ��ʱ��HI�����������Ϊ0.60,��a,b,c�Ĺ�ϵ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��12�֣���һ���¶��µ�2 L�ܱ������г���0.4 molSO2��0.2 mol O2 ��������Ӧ��2SO2(g)+O2(g) 2SO3(g) ��H ��0��n(O2)��ʱ��ı仯��ͼʵ����ʾ��
��1����SO2��ʾ0��4 min�ڸ÷�Ӧ��ƽ������Ϊ �����¶��·�Ӧ��ƽ�ⳣ��KΪ �������¶�Kֵ ������������䡱��С������
��2�����¶Ȳ��䣬���������ټ�1 mol O2�����´ﵽƽ�⣬��SO2��ƽ��Ũ��
������������䡱��С������������ת���� ������ߡ��������䡱���͡�����SO3��������� ������������䡱��С������
��3�����ı�ijһʵ�������ٽ�������ʵ�飬���O2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı���_____________________________������II��Ӧ��ʵ�������ı���______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�߶���һ���¿���ѧ�Ծ� ���ͣ������
��12�֣���һ���¶��µ�2 L�ܱ������г���0.4 mol
SO2��0.2 mol O2 ��������Ӧ��2SO2(g)+O2(g)  2SO3(g)
��H ��0��n(O2)��ʱ��ı仯��ͼʵ����ʾ��
2SO3(g)
��H ��0��n(O2)��ʱ��ı仯��ͼʵ����ʾ��
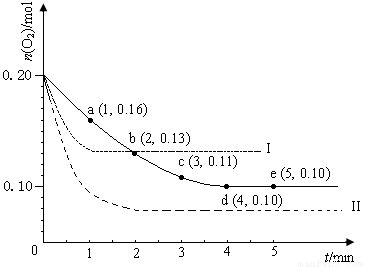
��1����SO2��ʾ0��4 min�ڸ÷�Ӧ��ƽ������Ϊ �����¶��·�Ӧ��ƽ�ⳣ��KΪ �������¶�Kֵ ������������䡱��С������
��2�����¶Ȳ��䣬���������ټ�1 mol O2 �����´ﵽƽ�⣬��SO2��ƽ��Ũ��
������������䡱��С������������ת���� ������ߡ��������䡱���͡�����SO3��������� ������������䡱��С������
��3�����ı�ijһʵ�������ٽ�������ʵ�飬���O2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı���_____________________________������II��Ӧ��ʵ�������ı���______________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com