
【题目】完成下列填空:
(1)要使 NH3 与 CH4 含相同数目的 H 原子,则 NH3 和 CH4 的物质的量之比为_______。
(2)19g 某二价金属氯化物(ACl2)中含有 0.4mol Cl, ACl2 的化学式是_____。
(3)在标准状况下,V L H2 中含有 N 个氢分子,则阿伏加德罗常数为_____mol-1。
(4)实验室某盐酸试剂的密度为 1.19g/mL,质量分数为 36.5%,则该盐酸的物质的量浓度为_____mol·L-1。
【答案】4∶3 MgCl2 ![]() 11.9
11.9
【解析】
(1)NH3与CH4分子分别含有3个H原子、4个H原子;
(2)依据摩尔质量的概念分析计算,摩尔质量数值上等于其相对分子质量,依据化学式计算A的相对原子质量,判断元素种类写出化学式;
(3)根据n=V/Vm计算氢气物质的量,结合N=nNA计算;
(4)根据c=1000ρw/M计算。
(1)设NH3和CH4的物质的量分别为x、y,由NH3与CH4分子分别含有3个H原子、4个H原子可得:3x=4y,则x:y=4:3,故答案为:4:3;
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-,则ACl2的物质的量为0.2mol,摩尔质量=19g/0.2mol=95g/mol,ACl2中A的相对原子质量=95-35.5×2=24,依据相对原子质量为24可知A为镁,ACl2的化学式为MgCl2,故答案为:MgCl2;
(3) 氢气物质的量为VL/22.4L/mol =V/22.4mol,则N=V/22.4×NA,故NA=22.4N/Vmol-1,故答案为:22.4N/V;
(4)由c=1000ρw/M,可知该浓盐酸的物质的量浓度为:(1000×1.19×36.5%)/36.5mol/L
=11.9mol/L,故答案为:11.9。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有机物N是制备某药品的中间体,其合成路线如下(部分产物和条件已略):

已知:RCN![]() RCOOH
RCOOH![]() RCOCl
RCOCl![]() RCOOR'
RCOOR'
请按要求回答下列问题:
(1)已知A标准状况下的密度为1.25g/L,则A的结构简式为_______;其分子共平面的原子数目为____________。
(2)B的官能团名称为________。反应①的反应类型为_______。F的名称为_______ 。
(3)P是比A相对分子质量大28的同系物,P的所有可能的结构(含p)数目为______。写出P的属于环烃的同分异构体的结构简式: ______ 。
(4)写出反应②的化学方程式: ______。
(5)已知:  。參照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):_______________。
。參照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)依据第2周期元素第一电离能的变化规律,参照下图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置_______。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F。基态铜原子的核外电子排布式为________。
NF3+3NH4F。基态铜原子的核外电子排布式为________。
(3)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
(4)已知苯酚![]() 具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子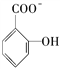 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酸)(填“>”或“<”),其原因是______________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酸)(填“>”或“<”),其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
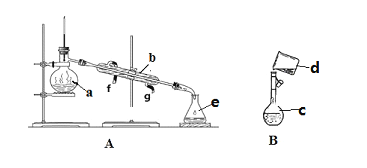
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)若利用装置分离酒精和水的混合物,还缺少的仪器是______,冷凝水由___口流出(填f或g)。
(3)现需配制0.1mol/LNaOH溶液450mL,装置B是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)R单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图所示。A中原子堆积方式为________堆积,A、B中R原子的配位数之比为________。
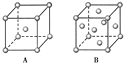
(2)已知单质D为面心立方晶体,如图所示,D的相对原子质量为M,密度为8.9 g/cm3。

试求:
①图中正方形边长=________cm(只列出计算式,NA表示阿伏加德罗常数的值)。
②试计算单质D晶体中原子的空间利用率:________(列出计算式并化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用0.1000mol/LNaOH滴定25.00 mL 0.1000 mol/L某一元酸HX,滴定过程中pH变化曲线如图所示。下列说法正确的是 ( )

A. 滴定前,酸中c(H+)等于碱中c(OH-)
B. 在A点,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-)
C. 在B点,两者恰好完全反应
D. 在C点,c(X-)+c(HX)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断该溶液呈中性的依据是:
A. a=b
B. 混合溶液的pH值为7
C. 混合溶液中C(H+)=![]()
D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中,实验室可用如图装置制取无水氯化铁(已知:FeCl3固体易吸收空气中的水发生潮解)。请回答下列问题:

(1)盛放浓盐酸的仪器名称为_______________。
(2)烧瓶中发生反应的化学方程式为__________________________________。
(3)C瓶中的试剂是________________。
(4)玻璃管D中发生反应的化学方程式为______________________________,反应现象是__________________________。
(5)干燥管E中盛有碱石灰,其作用是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com