
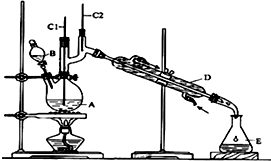
 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
分析 ①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中,该物质作催化剂,注意先后顺序,相当于稀释浓硫酸;
②在A中加入4.0g正丁醇和几粒沸石,沸石防暴沸,加热;当有蒸汽出现时,开始滴加B中溶液,滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分,得到的馏分中含有正丁醛;
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g,得到正丁醛;
(1)B仪器的名称是分液漏斗,D仪器的名称是冷凝管;
(2)正丁醛密度小于水,且在水中溶解度较小;
(3)温度过高,正丁醛能被氧化生成丁酸;
(4)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O列方程计算.
解答 解:①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中,该物质作催化剂,注意先后顺序,相当于稀释浓硫酸;
②在A中加入4.0g正丁醇和几粒沸石,沸石防暴沸,加热;当有蒸汽出现时,开始滴加B中溶液,滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分,得到的馏分中含有正丁醛;
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g,得到正丁醛;
(1)B仪器的名称是分液漏斗,D仪器的名称是冷凝管,故答案为:分液漏斗;冷凝管;
(2)正丁醛密度小于水,且在水中溶解度较小,所以将正丁醛粗产品置于分液漏斗中分液时,水在下层,故答案为:下;
(3)温度过高,正丁醛能被氧化生成丁酸,且能保证及时蒸出正丁醛,故答案为:保证正丁醛及时蒸出;又可尽量避免其被进一步氧化(或温度过高被氧化为丁酸);
(4)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
74:4=4xg:2g
解得:x=$\frac{74×2}{72×4}$×100%=51.4%,
故答案为:51.4.
点评 本题考查物质制备,为高频考点,涉及实验基本操作、基本计算、仪器的选取和用途、物质分离和提纯等知识点,明确实验原理及基本操作方法、仪器用途等知识点即可解答,知道(4)题产率的计算方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO | |
| B. | BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO | |
| C. | Be(OH)2只能溶于盐酸,不能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
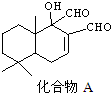
| A. | A的分子式为C15H20O3 | B. | 能发生银镜反应 | ||
| C. | 分子中有3个手性碳原子 | D. | 1molA最多与1molH2完全加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
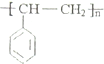 .根据所学知识,可以判断( )
.根据所学知识,可以判断( )| A. | 聚苯乙烯能使溴水褪色 | |
| B. | 聚苯乙烯是一种天然高分子化合物 | |
| C. | 聚苯乙烯可由苯乙烯通过化合反应制得 | |
| D. | 聚苯乙烯单体的分子式为C8H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
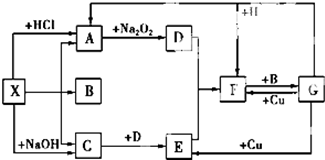 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题:
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com