
氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.
Ⅰ. 氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:
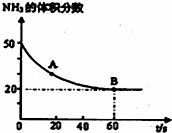
CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:则A点的逆反应速率V(逆)(CO2)<B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 .
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s)⇌2NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为26.该反应的化学平衡常数的表达式为K= .
Ⅱ.氮的氧化物会污染环境.
(3)采取还原法,用炭粉可将氮的氧化物还原.
已知:N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol﹣1, C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
写出炭粉还原一氧化氮的热化学反应方程式
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为 .若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为 .
考点: 化学平衡的计算;用盖斯定律进行有关反应热的计算;化学平衡常数的含义.
专题: 化学反应中的能量变化;化学平衡专题.
分析: (1)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,即B点时v正(CO2)=v逆(CO2);
A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,则A点的逆反应速率小于B点的逆反应速率,所以A点的逆反应速率V(逆)(CO2)小于B点的正反应速率V(正)(CO2);依据氨气的体积分数结合平衡三段式列式计算平衡转化率;
(2)根据平均相对分子质量= 进行计算;化学平衡常数的表达式为生成物浓度幂次方之积比上反应物浓度幂次方之积;
进行计算;化学平衡常数的表达式为生成物浓度幂次方之积比上反应物浓度幂次方之积;
(3)根据盖斯定律来计算化学反应的焓变,从而书写热化学方程式;
(4)9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,即每2mol NO2和Na2CO3溶液反应时转移电子1mol计算生成的硝酸,根据化合价的变化判断生成物,以此书写反应的离子方程式.
解答: 解:(1)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,即B点时v正(CO2)=v逆(CO2);
A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,则A点的逆反应速率小于B点的逆反应速率,所以A点的逆反应速率V(逆)(CO2)小于B点的正反应速率V(正)(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3⇌(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50﹣0.5x 50﹣x 0.5x
氨气的体积分数即物质的量分数= =20%;
=20%;
计算得到x=37.5mol
氨气的平衡转化率= ×100%=75%,
×100%=75%,
故答案为:<;75%;
(2)平均相对分子质量= =
= =26;化学平衡常数K=c(NH3)2c(CO2);故答案为:26;K=c(NH3)2c(CO2);
=26;化学平衡常数K=c(NH3)2c(CO2);故答案为:26;K=c(NH3)2c(CO2);
(3)已知:①N2(g)+O2(g)═2NO(g)△H=+180.6kJ•mol﹣1
②C(s)+O2(g)═CO2(g)△H=﹣393.5kJ•mol﹣1
则②﹣①得到,C(s)+2NO(g)═CO2(g)+N2(g)△H=﹣393.5kJ•mol﹣1﹣180.6kJ•mol﹣1=﹣574.1kJ•mol﹣1,
故答案为:C(s)+2NO(g)═CO2(g)+N2(g)△H=﹣574.1kJ•mol﹣1;
(4)9.2gNO2的物质的量 =0.2mol,即0.2molNO2和Na2CO3溶液完全反应时转移电子0.1mol,则2molNO2和Na2CO3溶液反应时转移电子1mol,则N的化合价分别有+4价变化为+5价和+3价,在碱性溶液中应生成NO3﹣和NO2﹣,反应的离子方程式为:2NO2+CO32﹣=NO3﹣+NO2﹣+CO2,若生成的CO2完全逸出,NO2﹣水解成碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3﹣)>c(NO2﹣)>c(OH﹣)>c(H+);
=0.2mol,即0.2molNO2和Na2CO3溶液完全反应时转移电子0.1mol,则2molNO2和Na2CO3溶液反应时转移电子1mol,则N的化合价分别有+4价变化为+5价和+3价,在碱性溶液中应生成NO3﹣和NO2﹣,反应的离子方程式为:2NO2+CO32﹣=NO3﹣+NO2﹣+CO2,若生成的CO2完全逸出,NO2﹣水解成碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3﹣)>c(NO2﹣)>c(OH﹣)>c(H+);
故答案为:2NO2+CO32﹣=NO3﹣+NO2﹣+CO2;c(Na+)>c(NO3﹣)>c(NO2﹣)>c(OH﹣)>c(H+);
点评: 本题为综合题,考查了盖斯定律求热化学方程式,化学平衡的移动及平衡的计算,氧化还原方程式的书写,题目难度大,熟悉平衡原理是解题关键.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出X kJ热量.已知单质C(s)的燃烧热为Y kJ/mol,则1mol C(s)与O2(g)反应生成CO(g)的反应热△H为( )
|
| A. | ﹣Y kJ/mol | B. | ﹣(10X﹣Y)kJ/mol |
|
| C. | ﹣(5X﹣0.5Y) kJ/mol | D. | +(10X﹣Y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
为除去混在氯化钾中的少量硫酸钾和氯化钙杂质,需进行下列六项操作:
①加水溶解②加热蒸发结晶 ③加入过量氯化钡溶液 ④加入过量盐酸 ⑤加入过量碳酸钾溶液 ⑥过滤.
正确的操作顺序是()
A. ①③⑤⑥④② B. ①⑤③④⑥② C. ①③④⑥⑤② D. ①⑤③⑥④②
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内的气体一定具有相同的( )
A. 质量 B. 原子总数 C. 碳原子数 D. 密度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图中的实验方案,能达到实验目的是()
A B C D
实验
方案 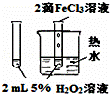
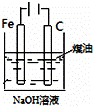


实验
目的 验证FeCl3对H2O2分解反应有催化作用 制备Fe(OH)2并能较长时间观察其颜色 除去CO2气体中混有的SO2 比较HCl、H2CO3和H2SiO3的酸性强弱
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,把1molN2O4气体通入体积为10L的真空密闭容器中,立即出现红棕色,反应进行4s时,NO2的浓度为0.04mol·L-1,再经过一定时间后,反应达到平衡,这时容器内的压强为开始时的1.8倍。则正确的是( )
A.前4s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.4s时容器内的压强为开始时的1.2倍
C.平衡时容器内含0.4molN2O4
D.平衡时容器内含0.8molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列能用勒夏特列原理解释的是( )
A.高温及加入催化剂都能使合成氨的反应速率加快
B.红棕色的NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
反应N2(g)+3H2(g) 2NH3(g) ΔH<0,在某一时间段中反应速率与反应过程的曲线关系如下图,则氨的百分含量最高的一段时间是( )
2NH3(g) ΔH<0,在某一时间段中反应速率与反应过程的曲线关系如下图,则氨的百分含量最高的一段时间是( )
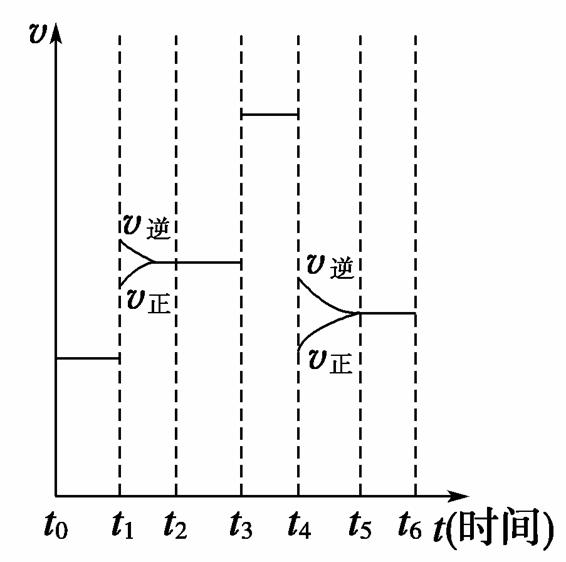
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com