
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/mol。
2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。
【答案】 bc 变深 正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增加,颜色加深 (p总·x)2(NO2)/x(N2O4) 温度 k正/k逆 3.9×106 ![]()
【解析】(1)a.应是2v正(N2O4)=v逆(NO2) 时反应达到平衡状态,故a错误;b.体系颜色不变,说明二氧化氮浓度不变,反应到达平衡状态,故b正确;c.混合气体总质量不变,随反应减小混合气体总物质的量增大,平均相对分子质量减小,当气体平均相对分子质量不变时,反应到达平衡状态,故c正确;d.混合气体的总质量不变,容器的容积不变,气体密度始终不变,故d错误,正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增加,颜色加深,故答案为:bc;变深;正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增加,颜色加深;
(2)由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比,N2O4(g)2NO2(g)的平衡常数Kp=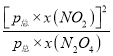 =
=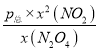 ,平衡常数只受温度温度影响,温度不变,平衡常数不变,故答案为:
,平衡常数只受温度温度影响,温度不变,平衡常数不变,故答案为: 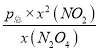 ;温度;
;温度;
(3)平衡时正逆速率相等,由v正=k正.p(N2O4),v逆=k逆.p2(NO2),联立可得Kp=![]() ,当N2O4分解10%时,设投入的N2O4为1mol,转化的N2O4为0.1mol,则:
,当N2O4分解10%时,设投入的N2O4为1mol,转化的N2O4为0.1mol,则:
N2O4(g)2NO2(g) 物质的量增大△n
1 2-1=1
0.1mol 0.1mol
故此时p(N2O4)= ![]() ×100kPa=
×100kPa=![]() ×100kPa,则v正=4.8×l04s-1×
×100kPa,则v正=4.8×l04s-1×![]() ×100kPa=3.9×106 kPas-1;故答案为:
×100kPa=3.9×106 kPas-1;故答案为: ![]() ;3.9×106;
;3.9×106;
(4)在温度为T时,平衡时N2O4分解百分率为a,设投入的N2O4为1mol,转化的N2O4为amol,则:
N2O4(g)2NO2(g)
起始量(mol):10
变化量(mol):a2a
平衡量(mol):1-a2a
故x(N2O4)= ![]() ,x(NO2)=
,x(NO2)= ![]() ,则平衡常数Kp=
,则平衡常数Kp=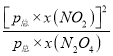 =
=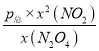 =p0×
=p0×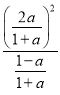 ,保持温度不变,平衡常数不变,令N2O4的平衡分解率为y,则:p0×
,保持温度不变,平衡常数不变,令N2O4的平衡分解率为y,则:p0× =2p0×
=2p0× ,解得y=
,解得y=![]() ,故答案为:
,故答案为: ![]() 。
。


科目:高中化学 来源: 题型:
【题目】研究小组进行如下表所示的原电池实验:
实验编号 | ① | ② |
实验装置 |
|
|
实验现象 | 连接装置5 分钟后,灵敏电流计指针向左偏转,两侧铜片表面均无明显现象 | 左侧铁片表面持续产生气泡,连接装置5 分钟后,灵敏电流计指针向右偏转,右侧铁片表面无明显现象 |
下列关于该实验的叙述中,正确的是
A. 两装置的盐桥中,阳离子均向右侧移动
B. 实验①中,左侧的铜被腐蚀
C. 实验②中,左侧电极的电极反应式为2H++ 2e-=H2↑
D. 实验① 和实验②中,均有O2 得电子的反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )
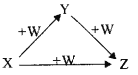
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe 和 Fe2O3 的混合物共 27.2g,加入 200mL 稀 H2SO4,在标准状况下收集到 2.24LH2,Fe和 Fe2O3 均无剩余。为中和过量的 H2SO4,并使 Fe 元素全部转化为 Fe(OH)2 沉淀,消耗了 400mL 3mol/L 的 NaOH 溶液,则该 H2SO4 的物质的量浓度为
A. 3mol/L B. 2.25mol/L C. 2mol/L D. 0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgN03溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgI>AgCl>Ag2S D. AgCl>AgI>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
A. KClO3发生化合价降低,失电子
B. 反应中H2SO4体现了酸性和强氧化性
C. 反应中H2C2O4被氧化
D. 产物中Cl与C化合价相同,因而氧化性一样强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5 mol NH3②标准状况下22.4 L He ③4 ℃ 9 mL水 ④19.6 g H3PO4
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com