
[化学—选修5:有机化学基础]对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(图中B1和B2、C1和C2分别互为同分异构体,无机产物略去):
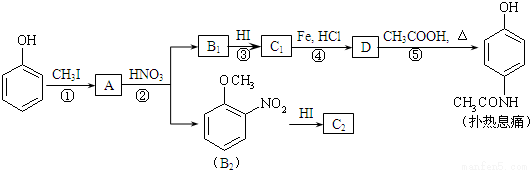
已知: ,请按要求填空:
,请按要求填空:
(1)写出A分子中官能团名称:_________;C1的结构简式为:___________________。
(2)写出由D生成扑热息痛的化学方程式:_______________________。
(3)学出反应③和④的反应类型:③______________,④__________。
(4)工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是:___________。
(5)扑热息痛有很多同分异构体,符合下列要求的同分异构体有5种:(1)是对位二取代苯;(II)苯环上两个取代基一个含氮不含碳、另一个含碳不含氮;(III)两个氧原子与同一原子相连。其中2种的结构简式是 和
和 ,写出另3种同分异构体的结构简式____________、____________、____________。
,写出另3种同分异构体的结构简式____________、____________、____________。
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:填空题
(1)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知:甲醇的燃烧热486为kJ·mol-1 ( 2CO (g) + O2(g) = 2CO2(g) △H b =-566.0 kJ·mol-1)
试写出CH3OH(l)在氧气中完全燃烧生成CO和H2O(l)的热化学方程式: 。
(2)常温下某溶液中由水电离的c(H+)=10-10 mol/L,则该溶液的pH为 _______。
(3)常温下,向V L pH=12的Ba(OH)2溶液中逐滴加入一定浓度的NaHSO4稀溶液,当溶液中的Ba2+恰好沉淀完全时,溶液pH=11。则Ba(OH)2溶液与NaHSO4溶液的体积比为__________,NaHSO4溶液的物质的量浓度为 。
(4)常温下,0.5mol/L的NH4Cl溶液的为pH=5.该溶液显酸性的原因是(用离子方程式表示) 。计算常温下氨水的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
下列各组中的离子,能在无色溶液中大量共存的是
A.H+、 K+、 CO32-、 SO42- B.Fe3+、Na+、NO3-、SO42-
C.Mg2+、Ba2+、OH-、NO3-  D.K+、Mg2+、NO3-、Cl-
D.K+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:实验题
辣椒中含辣椒素,局部应用可助减轻疼痛。辣椒素酯类化合物的结构可以表示为: (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:

已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰,峰面积比分别为9:1和3:1;
②化合物J的分子式为C15H22O4;
③
回答下列问题:
(1)G中含有的官能团有 、 。
(2)由C生成D的反应类型为 ,D的化学名称为 。
(3)①的化学方程式为 。
(4)J的结构简式为 。
(5)G的同分异构体中,苯环上的一氯代物只有一种的共有 种(不含立体异构),核磁共振氢谱显示2组峰的是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:选择题
下列实验操作能达到目的的是
实验目的 | 实验操作 | |
A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
B | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中再加水稀释 |
C | 确定Na2SO3样品是否部分被 氧化 | 取样于试管中,加入稀硝酸酸化,再滴加BaCl2溶液,观察是否有白色沉淀生成 |
D | 检验乙醇发生消去反应生成 乙烯 | 将生成的气体直接通入盛有酸性高锰酸钾溶液的试剂瓶,观察溶液是否褪色 |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:选择题
X、Y、Z、W均为短周期元素,且Y、Z、W在周期表的位置关系如下。已知X与W能形成最简单的有机物,则下列有关说法正确的是
|
|
| W |
Y | Z |
|
|
A.X能分别与Y、W形成化合物,且其所含化学键类型完全相同
B.W有多种同素异形体,且均具有高熔点、高沸点的性质
C.X的离子半径一定小于与Y同族的短周期元素的离子半径
D.Y、Z与X的常见稳定液态氧化物反应的剧烈程度Y大于Z
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三上质检二化学卷(解析版) 题型:实验题
焦亚硫酸钠(Na2S2O5)是一种食品添加剂.实验室用如图1所示装置制备Na2S2O5,实验步骤如下:

Ⅰ.在Na2CO3溶液中通入SO2 至pH为4.1,生成NaHSO3溶液;
至pH为4.1,生成NaHSO3溶液;
Ⅱ.加碳酸钠粉末调至pH为7~8;
Ⅲ.再通SO2至pH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体.
(1)制备焦亚硫酸钠总反应的化学方程式为 .
(2)Na2S2O5溶于水且与水能反应,所得溶液显酸性,其原因是 .步骤Ⅲ中测定溶液的pH的方法是 ;pH>4.1时,则产品中会有副产物,其化学式是 .
(3)利用碘量法可测定Na2S2O5产品中+4价硫的含量,实验方案为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中, ,重复如上步骤2次,记录数据.(实验中必须使用的试剂有:c1mol•L﹣1的标准碘溶液、c2mol•L﹣1的标准Na2S2O3溶液、冰醋酸、淀粉溶液、蒸馏水;已知:2Na2S2O3+I2═Na2S4O6+2NaI)
(4)含铬废水中常含有六价铬[Cr(Ⅵ)].利用Na2S2O5和FeSO4•7H2O先后分两个阶段处理含Cr2O72﹣的废水,实验结果如图.
①实验过程中 溶液的pH不断升高的原因是 .
溶液的pH不断升高的原因是 .
②已知:Ksp[Cr(OH)3]=6.4×10﹣31,lg2≈0.3,c(Cr3+)<1.0×10﹣5mol•L﹣1时视为完全沉淀.现将废水中Cr2O72﹣全部转化为Cr(OH)3而除去,需调节溶液的pH范围为 .
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三上质检二化学卷(解析版) 题型:选择题
下列实验设计及其对应的离子方程式均正确的是
A.用浓盐酸与铁屑反应制取H2:2Fe+6H +=2Fe3++3H2↑
+=2Fe3++3H2↑
B.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
C.用醋酸除去水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;
D.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:选择题
核反应不仅能发电也能制造元素.2016 年初国际上确认,利用原子核间的撞击已制造出原子序数分别为113、115、117 和118 四种新元素,填补了目前元素周期表的空白,其中113 号元素与Al 元素处于同一主族.下列说法正确的是( )
A. 核反应发电实现了化学能到电能的转化
B. 115 号元素一定是处于VA 族的非金属元素
C. 117 号元素与F 、Cl 、Br 、I 均处于VIIA 族
D. 四种新元素位于元素周期表中的不同周期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com