
焦亚硫酸钠(Na2S2O5)是一种食品添加剂.实验室用如图1所示装置制备Na2S2O5,实验步骤如下:

Ⅰ.在Na2CO3溶液中通入SO2 至pH为4.1,生成NaHSO3溶液;
至pH为4.1,生成NaHSO3溶液;
Ⅱ.加碳酸钠粉末调至pH为7~8;
Ⅲ.再通SO2至pH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体.
(1)制备焦亚硫酸钠总反应的化学方程式为 .
(2)Na2S2O5溶于水且与水能反应,所得溶液显酸性,其原因是 .步骤Ⅲ中测定溶液的pH的方法是 ;pH>4.1时,则产品中会有副产物,其化学式是 .
(3)利用碘量法可测定Na2S2O5产品中+4价硫的含量,实验方案为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中, ,重复如上步骤2次,记录数据.(实验中必须使用的试剂有:c1mol•L﹣1的标准碘溶液、c2mol•L﹣1的标准Na2S2O3溶液、冰醋酸、淀粉溶液、蒸馏水;已知:2Na2S2O3+I2═Na2S4O6+2NaI)
(4)含铬废水中常含有六价铬[Cr(Ⅵ)].利用Na2S2O5和FeSO4•7H2O先后分两个阶段处理含Cr2O72﹣的废水,实验结果如图.
①实验过程中 溶液的pH不断升高的原因是 .
溶液的pH不断升高的原因是 .
②已知:Ksp[Cr(OH)3]=6.4×10﹣31,lg2≈0.3,c(Cr3+)<1.0×10﹣5mol•L﹣1时视为完全沉淀.现将废水中Cr2O72﹣全部转化为Cr(OH)3而除去,需调节溶液的pH范围为 .
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA
B. 3.9g Na2O2晶体中含有0.2NA个离子
C.常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA
D. 3mol H2和1mol N2在一定条件下反应所得混合气体分子数大于2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
1g N2中含有x个原子,则阿伏加德罗常数是
A.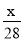 mol-1 B.14x mol-1 C.
mol-1 B.14x mol-1 C.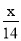 mol-1 D.28x mol-1
mol-1 D.28x mol-1
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:实验题
[化学—选修5:有机化学基础]对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(图中B1和B2、C1和C2分别互为同分异构体,无机产物略去):
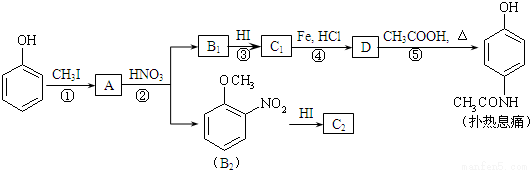
已知: ,请按要求填空:
,请按要求填空:
(1)写出A分子中官能团名称:_________;C1的结构简式为:___________________。
(2)写出由D生成扑热息痛的化学方程式:_______________________。
(3)学出反应③和④的反应类型:③______________,④__________。
(4)工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是:___________。
(5)扑热息痛有很多同分异构体,符合下列要求的同分异构体有5种:(1)是对位二取代苯;(II)苯环上两个取代基一个含氮不含碳、另一个含碳不含氮;(III)两个氧原子与同一原子相连。其中2种的结构简式是 和
和 ,写出另3种同分异构体的结构简式____________、____________、____________。
,写出另3种同分异构体的结构简式____________、____________、____________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:选择题
某太阳能电池的工作原理如图所示。下列说法正确的是

A.光照时,b极的电极反应式为VO2+-e-+H2O=VO2++2H+
B.光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移
C.夜间,a极的电极反应式为V3++e-=V2+
D.硅太阳能电池供电原理与该电池相同
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三上质检二化学卷(解析版) 题型:选择题
下列设计的实验方案能达到实验目的是
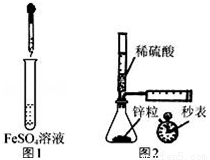
A. 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡
B. 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间
C. 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤
D. 检验淀粉是否水【解析】
取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三上质检二化学卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的4种短周期元素.X与Z位于同一主族,X原子的最外层电子数是次外层电子数的2倍,Y元素的单质既能与盐酸反应又能与NaOH溶液反应,X、Y、Z、W原子的最外层电子数之和为18.下列说法不正确的是
A. X单质在一定条件下能与Z的最高价氧化物发生置换反应
B. 原子半径:Y>Z>W
C. 最高价氧化物对应水化物的酸性由弱到强的顺序:X<Z<W
D. 室温下,0.1mol/LW的气态氢化物的水溶液的pH=1
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期末化学试卷(解析版) 题型:选择题
下列叙述正确的是 ( )
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH
D.镀层破损后,镀锌铁板比镀锡铁板更易腐蚀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二上学期期末考试化学试卷(解析版) 题型:实验题
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
Ⅰ.测定中和热.
写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________________________
(中和热数值为57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______________(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示 剂)。请回答下列问题:
剂)。请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为_________________。

(2)乙学生做了三组平行 实验,数据记录如下:
实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
滴定终点的判断__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com