
| 实验方案 | 可能的现象和相应的结论 |
| 实验方案 | 可能的现象和相应的结论 |
| 在试管气体发生装置中加入适量的固体样品和稀盐酸,组装好后将产生体依次通过盛有稀品红溶液、浓溴水、稀溴水和澄清石灰水的试管洗气装置. | 若品红褪色,溴水颜色变浅不浑浊,澄清石灰水变浑浊,该气体含有SO2、CO2的混合气体 |
| 若品红不褪色,溴水褪色(或变浅)且有浑浊出现,澄清石灰水变浑浊,该气体为H2S、CO2的混合气体 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 实验方案 | 可能的现象和相应的结论 |
在试管气体发生装置中加入适量的固体样品和稀盐酸,组装好后将产生体依次通过盛有稀品红溶液、浓溴水、稀溴水和澄清石灰水的试管洗气装置 在试管气体发生装置中加入适量的固体样品和稀盐酸,组装好后将产生体依次通过盛有稀品红溶液、浓溴水、稀溴水和澄清石灰水的试管洗气装置 |
若品红褪色,溴水颜色变浅不浑浊,澄清石灰水变浑浊,该气体含有SO2、CO2的混合气体 若品红褪色,溴水颜色变浅不浑浊,澄清石灰水变浑浊,该气体含有SO2、CO2的混合气体 |
若品红不褪色,溴水褪色(或变浅)且有浑浊出现,澄清石灰水变浑浊,该气体为H2S、CO2的混合气体 若品红不褪色,溴水褪色(或变浅)且有浑浊出现,澄清石灰水变浑浊,该气体为H2S、CO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源:肇庆二模 题型:问答题
| 实验方案 | 可能的现象和相应的结论 |
| ______ | ______ |
| ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究硫化钠晶体(Na2S?nH2O)在空气中的变化,某兴趣小组的实验步骤及现象记录如下:①将少量硫化钠晶体置于表面皿上,暴露在空气中。②三天后将样品放入盛水的烧杯中,搅拌后得到无色澄清溶液。③取少量该溶液加入过量盐酸中,有气体放出,且溶液保持澄清。
⑴请你根据上述记录猜想实验③中所放出气体的成分可能是(至少写出三种)]
。
⑵若所放出的气体为两种气体的混合气体,请利用以下装置探究混合气体的成分:
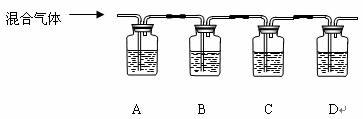
供选试剂为:澄清石灰水、品红溶液、浓溴水(试剂可重复使用)
①指出各瓶的试剂A___________B_____________C____________D____________。
②若A中现象为_______________________,则混合气体为______________________; 若A中现象为____________________,则混合气体为________________________;
③写出以上两种情况下B瓶中反应的化学方程式:____________________________;
_________________________________________________。
④本实验中浓溴水还可用(写名称)___________________________代替。
查看答案和解析>>
科目:高中化学 来源:2009年广东省肇庆市高考化学二模试卷(解析版) 题型:解答题
| 实验方案 | 可能的现象和相应的结论 |
| ______ | ______ |
| ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com