
��֪A��B��C��D��E�����ڱ���ǰ������ԭ�������������������Ԫ�ء�B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ����2��δ�ɶԵ��ӡ�A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����塣��EԪ�ص���������Һ���Ʊ�������Һ��ԭ��֮һ����Ҫ��ش��������⣺
��1������Ԫ���е�һ������������__________���縺��������__________��(�������վ���Ԫ�����ƣ�
��2����̬Eԭ�ӵļ۵����Ų�ʽΪ__________��EԪ�����������л�̬ԭ�ӵijɵ�����������Ԫ����__________����Ԫ�ط���)
��3��M������Bԭ�ӵĹ���ӻ�����Ϊ__________��M���������ּ��ǵĴ�С��ϵ��__________��(�á�XYZ��ʾ��X��Y��Z����Ԫ�ط���)
��4��C3-�Ŀռ乹��Ϊ__________��������CA3�ķе��BA4�ĸߣ�����Ҫԭ����__________��
��5����EԪ�ص���������Һ��ͨ�������CA3���õ�����ɫ������Һ���ڴ���Һ�м����Ҵ�,��������ɫ�ľ��壬�˾����д��ڵĻ�ѧ��������__________��������ţ�
A�����Ӽ� B���Ҽ� C���Ǽ��Թ��۽� D����λ�� E�������� F�����
��6����ͼ��D��E����Ԫ���γɵĻ�����ľ����ṹʾ��ͼ��D����λ��Ϊ__________����֪�������������Dԭ�Ӽ����Ϊanm,����٤��������NA��ʾ����þ�����ܶ�Ϊ__________g/cm3(�ú�a��NA�ı���ʽ��ʾ)

 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ��У��һ3���¿���ѧ�Ծ��������棩 ���ͣ��ƶ���
A��B��C��D��EΪԭ��������������Ķ�����Ԫ�أ���֪A��B��E����ԭ������㹲��11�����ӣ�����3��Ԫ�ص�����������ˮ�����������ܷ�����Ӧ�����κ�ˮ��CԪ�������������ȴ�����������4��DԪ��ԭ�Ӵ�����������������������3��
��1��д��Ԫ�ص����ƣ�C__________��D___________��
��2��д��Ԫ�ص�ԭ�ӽṹʾ��ͼ��A______________��B______________���������Ӱ뾶��_______��_________ (�ѧʽ����ͬ)��
��3��A��B������������ˮ����ļ��ԣ�______________��______________��
��4��D��E����̬�⻯����ȶ��ԣ�______________��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ��ͨ�и����߿�ȫ��ģ�⣨������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й���Ԫ�ؼ��仯����ı�ʾ��ȷ���ǣ� ��
A. ��ԭ�ӵĽṹʾ��ͼ��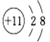
B. �������Ƶĵ���ʽ: 
C. С�մ���ˮ�еĵ��뷽��ʽ��NaHCO3=Na++HCO3-
D. ���Ƶ�ˮ��Һ�ʼ��Ե�ԭ��S2-+2H2O H2S+2OH-
H2S+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�����и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ����±�������˵����ȷ����
Ԫ�ط��� | X | Y | Z | M | R | Q | |
ԭ�Ӱ뾶(1��10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
��Ҫ���ϼ� | ������� | +1 | +1 | +3 | +7 | +5 | �� |
����� | -1 | �� | �� | -1 | -3 | -2 | |
A. ���Ӱ뾶��Y>Z>M
B. Y��Z��M����Ԫ�ص�����������ˮ��������֮��ᷴӦ
C. ������XM��YM���ǵ���ʣ�����״̬�¶��ܵ���
D. Ԫ��Z��M��R�����Ӿ����ƻ�ˮ�ĵ���ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�����и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���б���ʽ�������
A. ����ĵ���ʽ��
B. ��ԭ�ӵ�L����ӹ����ʾʽ��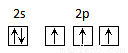
C. ̼-12ԭ�ӣ�
D. �����ӵĺ�������Ų�ʽ��1s22s22p63s23p4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ɹŰ�ͷ�и�����ѧ�ڵ�һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������������ʹ�õ�ȼ����ƫ������(C2H8N2)����ʹ��������������Ϊ��������������ϵ������ŵ��ǣ������ڶ�ʱ���ڲ������������������̫�գ������ֲ���Ⱦ����(���ﶼ�ǿ����ɷ֣���ijУ���о���ѧϰС���⽫��ԭ�����Ϊԭ��أ���ͼ��ʾ�����ѧϰ���ĵ绯ѧԭ����������Ʒ���������˵����ȷ���ǣ� ��

A. A����
B. ��ع���ʱH+��A����B��Ǩ��
C. ��b ��ͨ��������������������B������������Ӧ
D. A�������ĵ缫��Ӧʽ��C2H8N2+4H2O+16e-=2CO2+N2+16H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
�������γɶ������ӣ���N3����NH2����N3����NH4+��N2H5+��N2H62+�ȣ���֪N2H5+���γɹ���������NH4+���γɹ��̣�N2H5+�ڼ�����Һ�����ɵ����Եķ��Ӻ�H2O��
�ٸõ����Է��ӵĻ�ѧʽ_______�� ��һ��N3�����и�_______���ӣ�
��д�������ɶ��ԭ����ɵĺ�����N3����������ͬ�����ʵĻ�ѧʽ__________��_______________��
ijԪ�ص��⻯��ΪHnR����������������ˮ��������к���m����ԭ�ӣ�����ˮ����Ļ�ѧʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����Ԫ�����ڱ���Ԫ�������ɣ������ƶ���ȷ���ǣ�������
A. Mg(OH)2�ļ��Ա�Be(OH)2���� B. H3BO3�����Ա�H2CO3���� 
C. HCl��HBr��HI�����ȶ����� ����ǿ D. ��M+��R2���ĺ�����Ӳ�ṹ��ͬ����ԭ��������R��M
����ǿ D. ��M+��R2���ĺ�����Ӳ�ṹ��ͬ����ԭ��������R��M
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ��ͨ�и����߿�ȫ��ģ�⣨�壩��ѧ �Ծ��������棩 ���ͣ�ʵ����
ʵ������NaClO3��Na2SO3��ȡClO2���壬����ClO2��ǿ�����������������H2O2��Ӧ�Ƶ�Ư��NaClO2��װ������ͼ��ʾ����

��֪��
��I��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO3��3H2O������38��ʱ����������NaClO2��
����30 % H2O2����40��ʱ����ȫ�ֽ⣻
������60��ʱNaClO2�ֽ��NaClO3��NaCl��

��1��װ��A�����ķ�Ӧ�У���ԭ����________��
��2����װ��B�з�Ӧ����NaClO2�Ļ�ѧ����ʽΪ____________��
��ʵ����Bװ��������¶ȿ��Ʋ�����40�棬�ڲ��ı�NaOH��ҺŨ�Ⱥ�����������£��ɲ�ȡ�Ĵ�ʩ��________��_______��
��3���벹���װ��B��Ӧ�����Һ�л��NaClO2����IJ������衣
����55 ��ʱ�����ᾧ����_______���� ________����________���õ���Ʒ��
��4��װ��C��������______________��
��5��֤��ʵ���װ��B���û����Һ�е�NaClO2���������Ե�ʵ�鷽����________�����ɹ�ѡ�õ��Լ���ϡH2SO4��FeCl2��Һ��KSCN��Һ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com