
【题目】将等体积的AlCl3溶液和NaOH溶液混合充分反应后,沉淀中所含的铝元素的物质的量和溶液中所含铝元素的物质的量相等。则氯化铝溶液和氢氧化钠溶液的物质的量浓度之比为 ( )
A.2:3B.2:5C.2:1D.2:9
【答案】A
【解析】
氯化铝中加入氢氧化钠,先发生反应生成氢氧化铝沉淀,氢氧化钠过量,氢氧化钠与氢氧化铝反应生成偏铝酸钠,所以得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝元素存在形式可能为AlCl3或NaAlO2,结合反应:Al3++3OH-═Al(OH)3↓或Al3++4OH-=AlO2-+2H2O,讨论进行计算。
氯化铝中加入氢氧化钠,先发生反应生成氢氧化铝沉淀,氢氧化钠过量,氢氧化钠与氢氧化铝反应生成偏铝酸钠,所以得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝元素存在形式可能为AlCl3或NaAlO2,设氢氧化铝物质的量为1mol,
如果溶液中铝元素以AlCl3存在,NaOH完全反应,则:
![]()
则原来AlCl3的物质的量为1mol+1mol=2mol,NaOH为3mol,则:AlCl3和NaOH两种溶液物质的量浓度之比=2mol:3mol=2:3;
如果溶液中铝元素以NaAlO2存在,氢氧化钠完全反应,氢氧化铝部分溶解,
![]()
![]()
则原来AlCl3的物质的量为1mol+1mol=2mol,NaOH为3mol+4mol=7mol,则:AlCl3和NaOH两种溶液物质的量浓度之比=2mol:7mol=2:7,
答案选A。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
A. 纯净的液氨中,pN=7
B. 液氨达到电离平衡时c(NH3)=c(NH4+)+c(NH2-)
C. 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D. 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用泛的金属之一,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物![]() 的化学式。实验中称取0.54g的
的化学式。实验中称取0.54g的![]() 样品,溶解后先进行阳离子交换预处理,再通过含有饱和
样品,溶解后先进行阳离子交换预处理,再通过含有饱和![]() 的阴离子交换柱,使
的阴离子交换柱,使![]() 和
和![]() 发生交换。交换完成后,流出溶液的
发生交换。交换完成后,流出溶液的![]() 用
用![]() 的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出
的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出![]() 中x的值为_________(取整数)。
中x的值为_________(取整数)。
(2)在实验室中,FeCl2可用铁粉和_________反应制备,FeCl3可用铁粉和_________反应制备。现有一瓶FeCl2溶液,某同学欲检验该溶液是否已经变质,首先取适量溶液于洁净的试管中,然后向溶液中滴加几滴______________,观察溶液是否变成红色即可得出结论。
(3)FeCl3与氢碘酸混合时有棕色物质生成,写出该反应的离子方程式:________;工业上还可以用FeCl3溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是____________。(填序号)。
A.若无固体剩余,则溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子
四种离子
B.若溶液中有![]() ,则体系中一定没有固体剩余
,则体系中一定没有固体剩余
C.若有固体剩余,则溶液中一定有反应![]() 发生
发生
D.当溶液中有![]() 存在时,则一定没有
存在时,则一定没有![]() 析出
析出
(4)高铁酸钾(![]() )是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在
)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在![]() 中铁元素的化合价为_________,
中铁元素的化合价为_________,![]() 与
与![]() 在强碱性条件下反应可制取
在强碱性条件下反应可制取![]() ,其反应的离子方程式为________。
,其反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

①浓H2SO4与Cu反应的化学方程式是____________________________________。
②试剂a是____________。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:__________。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________。
(3)根据沉淀F的存在,推测![]() 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,![]() 被氧化为
被氧化为![]() 进入D。
进入D。
实验三:探究![]() 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________:取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______。
②实验三的结论:__________。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和![]() 生成。
生成。
(6)根据上述实验所得结论:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氨水中,NH3·H2O电离达到平衡的标志是( )
A.溶液显电中性B.溶液中检测不出NH3·H2O分子的存在
C.c(OH-)恒定不变D.c(![]() )=c(OH-)
)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明亚硝酸是弱电解质的是( )
①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1HNO2溶液的pH=2
A.①②③
B.②③④
C.①④
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol·L-1的CH3COOH溶液中,c(H+)=1.0×10-3mol·L-1(忽略水的电离)。
(1)该温度下CH3COOH的电离度__。
(2)CH3COOH的电离平衡常数__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是重要的基础化工原料,下图是大学化学教材《有机化学基础》上由甲苯合成J的一种合成路线。
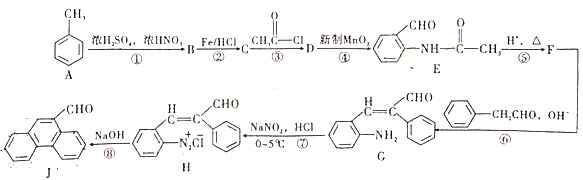
请依据上述流程回答以下问题
(1)B的化学名称为___________,J的分子式为___________。
(2)D生成E的反应类型为___________。
(3)设计第③步和第⑤步的目的是______________。
(4)由H生成J过程中生成的无机物除了![]() 外还有_________。
外还有_________。
(5)写出C→D的反应方程式为_______。
(6)D的同分异构体有多种。其中含有苯环和碳氧双键,且核磁共振氢谱有四组峰的有_________种。(不考虑立体异构)
(7)请依据流程图中相关信息,写出由甲苯和乙醛制备![]() 的合成路线________。(无机试剂任选)
的合成路线________。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在国际环境问题中,一次性使用的聚苯乙烯材料的“白色污染”甚为突出,这种材料难以分解,处理麻烦。最近研制出了一种新型的材料![]() 能替代聚苯乙烯。它是由乳酸缩聚而成的,该材料可在乳酸菌作用下发生降解。下列关于聚乳酸说法正确的是
能替代聚苯乙烯。它是由乳酸缩聚而成的,该材料可在乳酸菌作用下发生降解。下列关于聚乳酸说法正确的是
A.聚乳酸是一种纯净物
B.其聚合方式与聚苯乙烯相似
C.其单体为![]()
D.聚乳酸是一种线性高分子材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com